Способы передачи наследственной информации у бактерий
В 1928 г. Ф. Гриффите получил интересные данные по заражению мышей возбудителем пневмонии. Он использовал два штамма пневмококка: вирулентный штамм S (клетки его имеют полисахаридную капсулу и дают гладкие колонии) и невирулентный штамм R (клетки не обладают капсулой и образуют шероховатые колонии). Заражение мышей вирулентным штаммом вызывало их гибель. При инъекции невирулентного штамма мыши не болели. Пневмония у них не развивалась и после введения вирулентного штамма, убитого нагреванием. Однако, если мышам вводился одновременно убитый штамм S и живой штамм R, через некоторое время они погибали от пневмонии, а при посеве крови были выделены живые пневмококки с капсулой. Таким образом, можно было предполагать, что свойства убитого вирулентного штамма как бы перешли к живому невирулентному. Это явление было названо трансформацией.
Природу этого явления в 1944 г. установил О. Эвери. Он провел аналогичный эксперимент с пневмококками in vitro. Спонтанно штамм S мог мутировать, т. е. приобретать свойства штамма R, но обратная мутация (R→S), как правило, не происходит. Однако добавление к R экстракта убитых пневмококков S увеличивает вероятность обратной мутации. Эвери выделил вещество из убитых бактерий вирулентного штамма S, очистил, изучил химические свойства и назвал его трансформирующим фактором. Трансформирующий фактор инактивировался лишь одним ферментом — дезоксирибонуклеазой, расщепляющим только ДНК. Это означало, что трансформирующим веществом является ДНК. Так было получено первое подлинное доказательство генетической роли нуклеиновых кислот. Однако это открытие не сразу привлекло всеобщее внимание, поскольку в то время было мало известно о химической природе генов, структуре белков и ДНК. Тем не менее открытие Эвери стимулировало более детальное изучение нуклеиновых кислот. В 1947 г. Э. Чаргафф установил, что количество нуклеотидов ДНК и их соотношение у разных организмов неодинаково. Это навело на мысль, что порядок расположения нуклеотидов в молекуле ДНК, очевидно, как-то связан с ее генетической специфичностью.
Трансформация сводится к включению вещества хромосомы одной бактерии (донора) в хромосому другой (реципиента) и служит одним из способов обмена генетической информацией у бактерий. Однако механизм ее еще недостаточно изучен.
Долгое время считалось, что генетическая трансформация свойственна только одноклеточным. В настоящее время установлено, что явления, напоминающие генетическую трансформацию, могут происходить и в клетках эукариотов. При взаимодействии некоторых вирусов с клетками животных возможна трансформация эукариотной клетки. Полученная ею новая генетическая информация устойчиво передается при последующих клеточных делениях. Получены неоспоримые доказательства существования генетической трансформации в клетках млекопитающих. Дж. Берг и В. Мак-Брайд при культивировании клеток мыши в среде с изолированными хромосомами клеток человека выделили потомство клеток с маркерами последнего. (Имеются основания считать, что в геном реципиента включается лишь небольшой участок хромосомы донора, около 2 %.) Пока мало известно о характере связи между геномом реципиента и фрагментом хромосомы донора, но, несомненно, связь эта довольно прочная — клетки мыши не теряли приобретенные свойства даже при выращивании в неселективных условиях.
В 1952 г. Н. Циндер и Дж. Ледерберг описали еще один способ передачи наследственной информации у бактерий. Исследования проводились на бактериях мышиного тифа Salmonella fyphimurium. В U-образную трубку с бактериальным фильтром посередине засевались на полную питательную среду 2 штамма: в одну часть пробирки штамм 22А (ауксотрофный по мутации, тормозящей синтез триптофана Т-; это требовало добавления данной аминокислоты в среду для культивирования), в другую — штамм 2А дикого типа (способен синтезировать триптофан Т+). Совместное выращивание двух штаммов бактерий мышиного тифа привело к тому, что через некоторое время при посеве на минимальную среду бактерии штамма 22А дали небольшое количество колоний. Следовательно, они каким-то образом приобрели способность синтезировать триптофан. Переход бактерий из одного колена пробирки в другое преграждался бактериальным фильтром, а возможность обратной мутации штамма 22А исключалась, так как он был стабильным в этом отношении. По мнению Циндера и Ледерберга, перенос информации осуществлялся фагом. Было установлено, что ДНК-содержащие вирусы (фаги) делятся на две группы: паразиты, приводящие к гибели бактериальные клетки, и умеренные (симбиотические), не вызывающие заболевания и разрушения клеток.Умеренные вирусы, или профаги, существуют в клетке в виде ДНК, интегрированной с ДНК бактерии, и реплицируются вместе с ее хромосомой. Явление такого сосуществования умеренного фага и бактерии носит название лизогении. Лизогенная клетка (иначе клетка с профагом) обычно ничем не отличается от других бактерий. Обнаружить профаг удается лишь при активизации его ионизирующим и ультрафиолетовым излучением или при воздействии каких-либо иных факторов, вследствие чего он превращается в зрелый фаг, убивает клетку и использует ДНК бактерии на построение своей ДНК. Таким образом, профаг при заражении новой клетки может сообщить ей часть наследственной информации от старой. Штамм 2А оказался лизогенным по фагу, который из умеренного в силу каких-то причин превратился в паразитический и при заражении новых бактерий перенес в них часть фрагмента ДНК с геном, контролирующим синтез триптофана. Бактериальный фильтр не послужил преградой для вирусов, так как размеры их очень малы и они могут фильтроваться.
Явление переноса наследственной информации бактериофагом от одних бактерий к другим называется трансдукцией.Механизм трансдукции еще недостаточно изучен. Предполагается, что фрагмент чужеродной ДНК вначале самостоятельно реплицируется, а затем путем рекомбинации включается в хромосому клетки-реципиента. Трансдукция в настоящее время детально изучается в связи с вопросами генной инженерии, поскольку может рассматриваться в качестве одного из путей переноса наследственной информации от клетки к клетке.
В 1946 г. Дж. Ледерберг и Е. Татум при совместном выращивании двух ауксотрофных комплементарных мутантов кишечной палочки Е. coli (В-М-Р+Т+ и В+М+Р-Т-) в течение ночи получили культуру В+М+Р+Т+, которая оказалась способной в отличие от исходных штаммов расти на минимальной питательной среде без добавления метионина, биотина, треонина и пролина. Трансформации и трансдукции здесь явно не было. При наличии бактериального фильтра в сосудах, где выращивались культуры, взаимного обмена информацией не наблюдалось. Очевидно, существует очень тесный контакт между бактериями. На основании этого впервые было высказано предположение о возможности у бактерий полового процесса. Половой процесс у бактерий, при котором осуществляется перенос генетической информации при тесном контакте клеток, был назван конъюгацией.Впоследствии удалось получить микрофотографии конъюгирующих бактерий кишечной палочки. Передача информации при конъюгации носит односторонний характер.В 1952 г. Б. Хейс показал, что при конъюгации одна из клеток (мужская F+) служит донором, другая (женская F-) — реципиентом. Донорные клетки несут особый фактор F (фрагмент молекулы ДНК; автономно существует в цитоплазме и содержит около 10 пар нуклеотидов), являющийся нехромосомной структурой. Реципиенты этого фактора не имеют.
Процесс конъюгации и механизм переноса генетического материала был описан у бактерий Е. coli в 1955 г. В. Вольманом и Ф. Жакобом. Они показали, что при конъюгации фактор F может переходить из мужской клетки в женскую и превращать ее в F+. При этом другие свойства бактериальной клетки не изменяются. Передача полового фактора происходит как бы независимо от других генетических маркеров. Клетки штаммов F- внутри себя не рекомбинируют.
При обратной мутации половой фактор у бактерий может вновь приобрести автономное состояние. Освобожденный из хромосомы, подобно профагу, он иногда захватывает фрагмент бактериальной хромосомы, прилегающий к нему, и при конъюгации вместе с ним переходит в женскую клетку, сообщая ей свойства донорной клетки и некоторые другие свойства, контролируемые фрагментом хромосомы. Такой процесс переноса наследственной информации из одной бактериальной клетки в другую посредством полового фактора называется сексдукцией.
Таким образом, половой фактор является саморедуплицирующим генетическим элементом, способным существовать в двух состояниях: автономном и интегрированном в хромосому. Такие участки генетического материала получили название эписом.
Репликация ДНК
Уотсон и Крик уже во второй своей работе 1953 года предположили возможный механизм копирования наследственного материала. Легко представить, что цепи молекулы ДНК расходятся и каждая из них становится матрицей, на которой синтезируется новая комплементарная цепь. В результате образуются две дочерние двуспиральные молекулы ДНК, неотличимые от родительской молекулы.
Каждая молекула ДНК состоит из одной цепи исходной родительской молекулы и одной вновь синтезированной цепи. Такой механизм копирования называется полуконсервативным.В то же время обсуждались две другие модели, одна из них "консервативная" другая "дисперсионная" (Рисунок). Доказали существование полуконсервативной модели М. Мезелсон и Ф. Сталь в 1958 году. Авторы выращивали бактерии Е. coli несколько поколений на минимальной среде, в которой единственным источником азота был 15NH4C1 (хлорид аммония). В этом соединении нормальный изотоп 14N, был заменен на 15N. В результате все клеточные компоненты бактерий, включая пурины и пиримидины в молекулах ДНК содержали более тяжелый азот 15N. Затем клетки переносили на среду, содержащую изотоп 14N. Через 1 или 2 поколения выделяли ДНК и центрифугировали в градиенте CsCl. Фракции, содержащие легкие или тяжелые цепи, а так же гибридные 15N/14N, легко отделялись одна от другой.
В 1957 году Артур Корнберг (в 1959 году Артуру Корнбергу (Arthur Kornberg) была присуждена Нобелевская премия за открытие механизма биосинтеза ДНК) обнаружил у бактерии Е. coli фермент, катализирующий процесс полимеризации ДНК из нуклеотидов – ДНК-полимеразу. Открытие Корнберга показало, что в основе удвоения молекул ДНК лежат обычные биохимические реакции. По современным представлениям в репликации ДНК у прокариот выделяют следующие этапы: 1. Релаксация суперспирализованной ДНК. Этот процесс катализируется ферментом топоизомеразой. 2. Денатурация двойной спирали ДНК.
Поскольку синтез ДНК происходит на одноцепочечной матрице, ему должно предшествовать обязательное разделение двух цепей ДНК. Участок начала расхождения цепей называется репликационной вилкой из-за характерной Y-образной формы. Именно в этой репликационной вилке ДНК-полимеразы синтезируют дочерние молекулы ДНК.
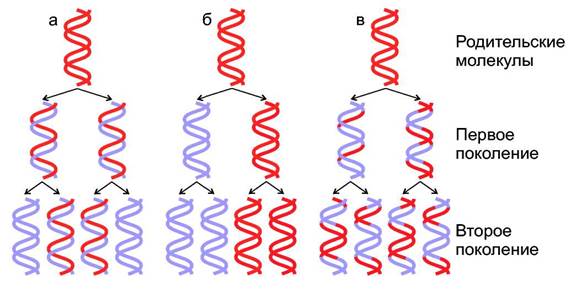
Модели репликации ДНК:
а - полуконсервативная, б - консервативная, в - дисперсионная.
Родительские цепи изображены в виде красных лент, вновь синтезированные
показаны синим цветом.
Участок ДНК, в котором репликация уже завершилась, выглядит как пузырек или "глазок" в нереплицированной ДНК. Репликационные глазки образуются в тех местах, где находятся специфические последовательности – точки начала репликации (origin of replication). Они состоят примерно из 300 нуклеотидов. С ориджина ими связываются инициаторные белки репликации.
Для того, чтобы цепи ДНК разъединились, функционирует особый фермент – ДНК-хеликаза, который связывается с инициаторными белками. Этот фермент движется по одиночной цепи ДНК и, встречая участок двойной спирали, он разрывает водородные связи между основаниями, разделяет цепи и продвигает репликационную вилку.
Субстратом для ДНК-полимеразы являются дезоксирибонуклеозид-трифосфаты (дНТФ), полимеризующиеся на одноцепочечной матрице. ДНК-полимеразы последовательно наращивают одну нить ДНК, шаг за шагом присоединяя к ней следующие звенья в направлении от 5' к 3' концу. В клетках присутствуют несколько разных типов ДНКполимераз, выполняющих различные функции и имеющих разное строение: они могут быть построены из различного количества белковых цепей (субъединиц), от одной до десятков. Однако, все они работают на любых последовательностях нуклеотидов матрицы; задача этих ферментов - сделать точную копию каждой матрицы.
Генетический материал живых организмов имеет огромные размеры и реплицируется с высокой точностью. В среднем, в процессе воспроизведения генома млекопитающего, состоящего из ДНК длиной 3 млрд. пар нуклеотидов, возникает не более трех ошибок. При этом ДНК синтезируется чрезвычайно быстро (скорость ее полимеризации колеблется в пределах от 500 нуклеотидов в секунду у бактерий до 50 нуклеотидов в секунду у млекопитающих).
Высокая точность репликации, наряду с ее высокой скоростью, обеспечивается наличием специальных механизмов, осуществляющих коррекцию, т.е. устраняющих ошибки.
Суть механизма коррекции заключается в том, что ДНК-полимеразы дважды проверяют соответствие каждого нуклеотида матрице: один раз перед включением его в состав растущей цепи, второй раз перед тем, как включить следующий нуклеотид. Очередная фосфодиэфирная связь синтезируется лишь в том случае, если последний нуклеотид растущей цепи ДНК образовал правильную уотсон-криковскую пару с соответствующим нуклеотидом матрицы.
Дата добавления: 2017-03-12; просмотров: 3047;











