Электрохимическая коррозия и защита металлов
Для понимания процессов электрохимической коррозии важное значение имеет механизм электропроводности.
В отношении проводимости электрического тока, исходя из различия, как величины, так и механизма электропроводности, все твердые и жидкие вещества можно с некоторой условностью разделить на четыре класса.
1 Металлы (электронные проводники), имеющие величину удельной
проводимости при обычных температурах 106 до 104Ом"1см"1. Проводимость в
металлах определяется движением свободных электронов.
2 Полупроводники, имеющие величину удельной проводимости отЮ5 до
10~10 Ом"'см-1. Проводимость полупроводников определяется перемещением
свободных электродов, которые, однако, в отличие от металлов, появляются в
зоне проводимости благодаря тепловой флуктуации, освещению и др. факто
рам.
3 Изоляторы или диэлектрики, имеющие проводимость порядка ICT^Om'W1 - IO^Om'W. Носители тока в диэлектриках почти отсутствуют.
4 Электролиты имеют электропроводность в интервале 10"1 Ом^см"1 -10"10Ом"1см"1. Носителями зарядов являются положительно и отрицательно заряженные ионы.
Прохождение тока в электронных проводниках, к которым принадлежат металлы, определяется движением электронов и не сопровождается ощутимым переносом массы; наоборот, прохождение тока в ионных проводниках (электролитах) сопровождается переносом вещества. При этом положительно заряженные катионы идут в одну сторону, к катоду, отрицательно заряженные анионы - обратную, к аноду.
Различие механизмов прохождения электрического тока через металлы и электролиты ведет к тому, что на границах электронного проводника (проводник первого рода) с электролитом (проводником второго рода) разряжается или, наоборот, образуется эквивалентное току количество ионов и, следовательно, выделяется или растворяется эквивалентное току количество вещества.
Первое и основное отличие электрохимического механизма коррозии от чисто химического состоит в том, что общая реакция химического взаимодействия реагента с металлом при электрохимической коррозии разделяется на два в значительной мере самостоятельно протекающих процесса:
- анодный процесс - переход металла в раствор в виде ионов с оставлением эквивалентного количества электронов металле;
- катодный процесс - ассимиляция появившихся в металле избыточных электронов каким-либо деполяризаторами (атомами, молекулами или ионами раствора, которые могут восстанавливаться на катоде).
Возможность такого разделения общей реакции коррозии является следствием существования ионов металла в растворе и свободных электронов в металле. Наличие электронной проводимости у металла и ионной проводимости у раствора позволяет, кроме того, анодным и катодным процессам протекать также и территориально раздельно на различных участках поверхности раздела металла и раствора. Это условие не обязательно для протекания электрохимического процесса, так как в некоторых условиях коррозии катодные и анодные процессы могут протекать на одной и той же поверхности, чередуясь по времени. Однако пространственное разделение анодной и катодной реакций оказывается энергетически более выгодным, так как анодные катодные реакции могут локализоваться на тех участках, где их протекание будет более облегчено. Поэтому в большинстве практических случаев протекание электрохимической коррозии обычно характеризуется локализацией анодного и катодного процессов на различных участках. Это второй важный признак, отличающий электрохимический механизм коррозионного процесса от чисто химического.
Если металл или металлическая конструкция находится под слоем электролита, то с электрохимической точки зрения мы можем рассматривать процесс коррозии как результат работы коррозионных гальванических элементов.
Рассмотрим основные ступени работы коррозионного гальванического элемента в соответствии с рисунком 11 {показано на фолии 38).
Анодный процесс, переход ионов металла в раствор и их гидратация в соответствии с уравнением
е <—[еМеТн2-9->Ме+*пН20,
(2)
где е - электрон;
Ме+ - ион металла;
Ме+*пН20 - гидратированный ион металла. Если бы никаких других электродных процессов в системе не происходило, то анодный процесс скоро должен был бы прекратиться. Накопление электронов в металле и катионов в растворе будет создавать сильное смещение электродного потенциала в отрицательную сторону, что затормозит дальнейшее протекание анодного процесса.
Катодный процесс, ассимиляция электронов каким-либо содержащимся в растворе деполяризатором (D) т.е. атомом или ионом, способным восстанавливаться (поглощать электрон) на катоде в соответствии с уравнением
е + D —> [D е], (3)
При параллельном протекании катодного процесса деполяризации анодный процесс может продолжаться неограниченно долго. В качестве катодной деполяризующей реакции в различных случаях коррозии могут служить самые разнообразные электродные процессы. Наиболее практически важными являются:
- катодная реакция восстановления иона водорода (Н+) в газообразный
водород (Н2) (водородная деполяризация) в соответствии с уравнением
Н++ е —> Н и далее Н+Н —> Н2, (4)
- катодная реакция восстановления кислорода (02) с превращением его в
ион гидроксила (ОН~) (кислородная деполяризация) в соответствии с уравнени
ем
02+2Н20+4е —> 40Н" (5)
Перетекание электричества. Так как анодный и катодный процессы независимы и более легко протекают - анодный на участках с более отрицательным начальным потенциалом поверхности, а катодный на более положительных - и так как в практических условиях всегда отмечается необходимая для этого электрохимическая неоднородность металлической поверхности, то
анодный и катодный процессы будут протекать преимущественно локализовано. Протекание тока между анодами и катодами будет осуществляться: в металле движением электронов от анодных участков к катодным, и в растворе -движением катионов от анодных участков к катодным и движением анионов от катодных участков к анодным. Важно отметить, что материальный эффект коррозионного разрушения металла при таком механизме будет проявляться на анодах; на катодных участках где происходит процесс деполяризации, потерь металла не будет.
Металл Электролит
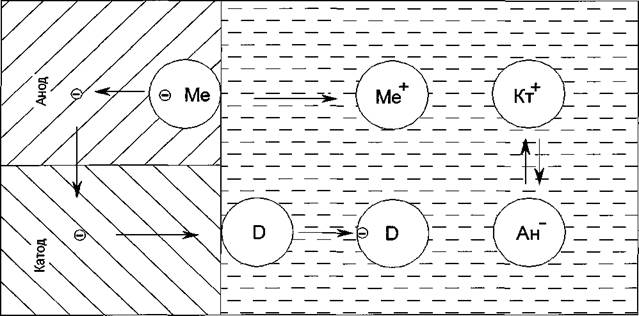
Рисунок 11 - Принципиальная схема работы гальванического элемента
Для того чтобы мог функционировать коррозионный гальванический элемент, требуется разделение поверхности на катодные и анодные участки. Это, очевидно, будет иметь место в том случае, когда электрохимический потенциал в разных участках поверхности будет неодинаков т. е. существует электрохимическая гетерогенность. Термином электрохимическая гетерогенность обозначают различие величин потенциалов и плотностей (либо направлений) токов на данной поверхности.
Существует много факторов, вызывающих электрохимическую гетерогенность металлической поверхности.
1 Наличие металлических или некоторых неметаллических, но электропроводных макро- или микровключений на металлической поверхности.
Включения с более положительным электродным потенциалом будут работать катодами.
2 Неоднородность распределения рыхлых продуктов коррозии. Участки под ржавчиной, как правило, более анодны.
3 Наличие неодинаковых по величине внутренних напряжений в различных точках металлического тела в результате неоднородной деформации или приложенных извне усилий. Более напряженные участки - аноды.
4 Различие в концентрации нейтральных солей в растворе. В зависимости от типа солей участки. Омываемые электролитом с большей концентрацией солей могут быть как анодами так и катодами.
5 Различие в концентрации водородных ионов (рН). Обычно участки, омываемые растворами с более высокими значениями рН становятся анодами.
6 Различие в концентрации кислорода или других окислителей. Участки, омываемые раствором с меньшей концентрацией кислорода или окислителя будут анодами.
7 Различие температуры у различных участков корродирующей поверхности. Более нагретые участки - аноды.
8 Неравномерное наложение внешнего электрического поля. Например, образование анодных и катодных участков под влиянием блуждающих токов при почвенной коррозии.
Случаи, когда электрохимическая гетерогенность вызывается только одним определенным фактором, сравнительно редки; чаще в образовании коррозионных элементов принимают участие многие факторы, и можно говорить только о превалирующем значении одного из них. Даже если основной материальный эффект коррозии вызывается макропарами, более или менее заметная коррозия будет происходить также и за счет работы микропар.
Поляризация как фактор, уменьшающий процесс электрохимической коррозии
Опустим в электролит два электрода с различными потенциалами. На электродах до их замыкания устанавливаются какие-то стационарные начальные значения потенциалов. На более положительном электроде - V°K. На более отрицательном - V°A. Начальное значение коррозионного тока в момент замыкания пары определится по закону Ома в соответствии с формулой
1„ач = (VUK - VUA) / R,
(6)
где 1нач. - начальное значение величины тока;
V к - начальное значение потенциалов на более положительном электроде;
V А - начальное значение потенциалов на более отрицательном электроде;
R - омическое сопротивление. Однако, по формуле (6), начальное значение величины тока (1нач) после замыкания пары быстро падает и через определенное время устанавливается равным какой-то устойчивой величине (I), во много раз меньше первоначальной. Так как омическое сопротивление во времени существенным образом не изменяется, то наблюдаемое уменьшение силы тока можно объяснить только изменением потенциалов электродов (V°K - V°A), протекающим именно таким образом, что с течением времени разность потенциалов катода и анода уменьшается до значения VK- VA. Очевидно что,
I = (VK - Va) / R, (7)
где VK и VA - эффективные потенциалы катода и анода при установившемся значении коррозионного тока I.
Уменьшение начальной разности потенциалов электродов гальванического элемента вследствие прохождения через него тока, приводящее к уменьшению величины тока после его замыкания, называется поляризацией коррозионного элемента.
Анодная поляризация - смещение потенциала анода в положительную сторону при прохождении анодного тока.
Катодная поляризация - смещение потенциала катода в отрицательную сторону при прохождении катодного тока.
Электродные процессы, уменьшающие поляризацию на аноде и катоде, принято называть процессами деполяризации.
Сущность явления поляризации сводится к тому, что перемещение электронов (отток от электрода при анодной поляризации и приток к электроду при катодной поляризации) совершается быстрее, чем электродные реакции.
Если при анодном процессе скорость перехода ионов металла в раствор будет отставать от процесса отвода электронов из анода во внешнюю цепь, то в
электроде будет скапливаться избыток положительных зарядов и, следовательно, потенциал анода сместится в положительную сторону. При катодном процессе, наоборот, в электрод поступают добавочные электроны, которые (если не успевают соединяться с деполяризатором) будут смещать потенциал катода в отрицательную сторону в соответствии с рисунком 12 {показано на фолии 39).
| / | Г | Л | ||||
| II 11 1 kfl 1 II II 1 1 1 1 II 1 1 1 1 1 1 1 | е | - -к - - | ||||
| 1' | ||||||
| © - 0 | ||||||
| , | \ | |||||
| --------------------------------- | ||||||
| Me- | " — ■i~Mo++ — — n ~ ~ >~ | |||||
Рисунок 12 - Схема поляризации коррозионного гальванического элемента
Поляризация тормозит работу локального элемента и уменьшает скорость электрохимической коррозии. Если бы не было явления поляризации, то процессы электрохимической коррозии шли бы с громадными скоростями, в сотни раз больше тех, которые наблюдаются.
Многоэлектродные системы
Во многих случаях коррозии упрощенный взгляд на корродирующую систему как на бинарный гальванический не пригоден. Поверхность корродирующего гетерогенного протяженного элемента является типичным примером многоэлектродной системы, так как отдельные структурные составляющие элемента будут иметь различные начальные потенциалы в коррозионном растворе. В данном случае некоторые электроды будут работать анодами, а некоторые катодами. Для общих случаев многоэлектродных систем характер работы ее составляющих зависит от удельной поляризуемости электродов, соотношения площадей электродов, взаимного расположения электродов в электролите, удельного сопротивления электролита.
Рассмотрим основные выводы теории многоэлектродных систем.
1 Электрод, имеющий начальный потенциал наиболее положительный, всегда будет катодом, наиболее отрицательный - анодом.
2 При более близком расположении промежуточных электродов к основным катодам для них возрастает возможность стать анодами, и, наоборот, при близости к основным анодам увеличивается возможность стать катодами.
3 Чем меньше поляризуемость основных катодов по сравнению с основными анодами, тем больше вероятность того, что промежуточные электроды будут работать анодами, Наоборот, при сравнительно малой поляризуемости основных анодов, для промежуточных электродов больше вероятность стать катодами.
Из вышесказанного следует, что возможны случаи, когда на гетерогенный корродирующей поверхности образовался один анод, а остальные все электроды будут катодами.
Постановка и решение вопросов коррозии многоэлектродных систем имеют большой практический смысл. Явление уменьшения скорости электрохимической коррозии металла при контакте с добавочным электродом, служащим анодом по отношению к данной корродирующей системе, положено в основу, нашедших в настоящее время широкое распространение, методов катодной электрохимической защиты.
Дата добавления: 2021-06-28; просмотров: 1005;











