Типы химических связей
Физико-химические основы материаловедения
Материаловедение- наука изучающая связь между структурой и свойствами материалов, а также их изменения при внешних воздействиях (тепловых, химических, механических и т.д.). Материаловедение условно разделяют на теоретическое и прикладное. Теоретическое материаловедение рассматривает общие закономерности строения материалов и процессов, происходящих в них при внешних воздействиях. Прикладное материаловедение направлено на нахождение оптимальной структуры и технологии переработки материалов при изготовлении конструкции изделий.
Материал промежуточный продукт переработки вещества в изделие, отвечающий потребностям конкретного производственного процесса и имеющий наперед заданную внутреннюю структуру и внешнюю форму. Это стальной прокат, Al-фольга, медная проволока, золотой микропровод, монокристаллический кремниевый слиток, полиэтиленовая пленка, ситалловые, керамические пластинки и др.
Вещество- вид материи, обладающий массой покоя. В трудовой деятельности человек использует вещества как основу продуктов труда, свойства которого обеспечивают желаемый результат. Но вместо понятия «вещественная основа» в технике принят термин «материал».
Сырье (сырые материалы), предметы труда, подвергшиеся ранее воздействию труда и подлежащие дальнейшей переработки (например, добытая руда).
Схема переработки сырья в изделие показана на рисунке 1.1.
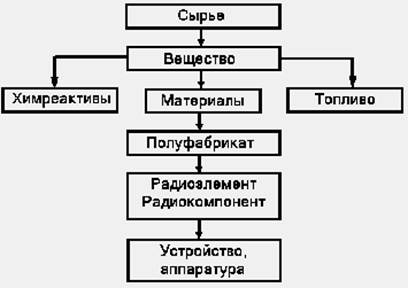 |
Рисунок 1.1- Схема переработки сырья в изделие
Пример перехода от сырья к устройству:
Сырье-(Fe-руда)- вещество (отливки стали)-материал (листовой прокат
стали)- полуфабрикат(основание и крышка стальные для корпуса ИМС)-радиоэлемент ( загерметизированная в стальной корпус микросхема)- устройство(ЭВМ, телевизор, радиоприемник на основе ИМС и др.) Есть примеры, когда сырье находит применение в радиоэлементе, минуя стадии материала, полуфабриката, например слюда для слюдяных конденсаторов, углерод для пленочных резисторов.
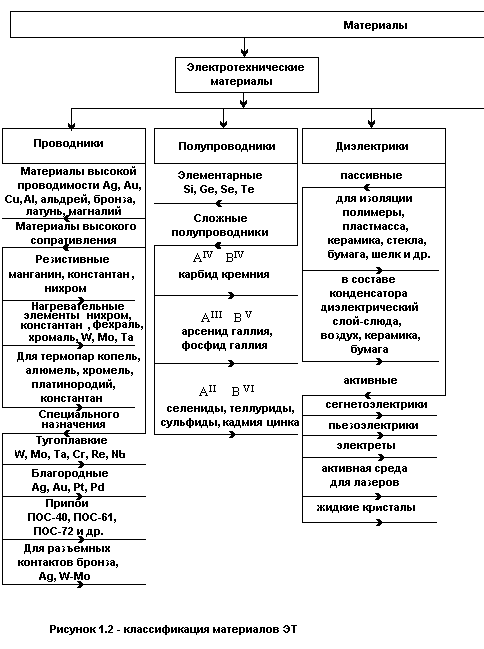
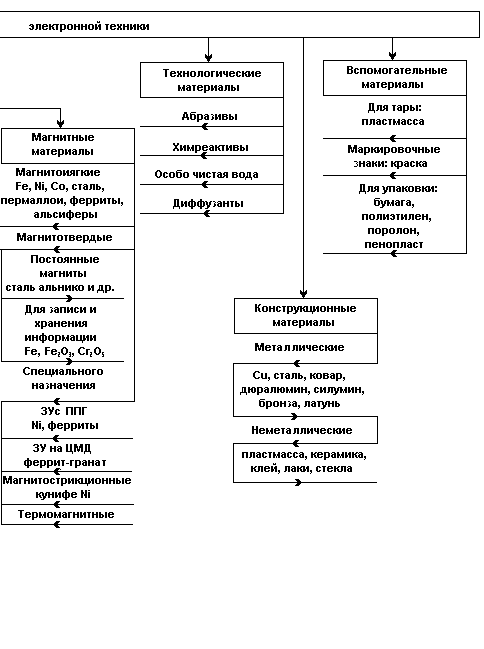
Классификация материалов ЭТ приведена на рисунке 1.2
 1.1 ОБЩИЕ СВЕДЕНИЯ О СТРОЕНИИ ВЕЩЕСТВА
1.1 ОБЩИЕ СВЕДЕНИЯ О СТРОЕНИИ ВЕЩЕСТВА
Типы химических связей
Все вещества построены из молекул, а молекулы из атомов. Атом состоит из положительно заряженного ядра, вокруг которого вращаются электроны. Каждый электрон испытывает не только притяжение со стороны ядра» но и отталкивание со стороны электронов. Внутренние электронные слои ослабляют притяжение внешних электронов к ядру. Электроны внешнего слоя называются валентными. Они слабее связаны с ядром и могут отрываться от одного атома и присоединяться к другому атому. Атом, лишившись одного или нескольких электронов, становится заряженным положительно, а атом, присоединивший к себе лишние электроны, заряжается отрицательно. Образующиеся заряженные частицы называют ионами. Ионы различных элементов могут соединяться между собой, образуя' молекулы. Молекула - наименьшая частица вещества, определяющая его химические свойства.
Рассмотрим основные виды связей, за счет которых происходит объединение атомов в молекулы.
Ковалентная связь возникает между атомами путем образования общих пар валентных электронов - по одному от каждого атома. Упрощенная схема ковалентной связи в молекуле водорода приведена на рисунке 1.3. Эти пары электронов становятся общими для атомов, входящих в состав молекулы.
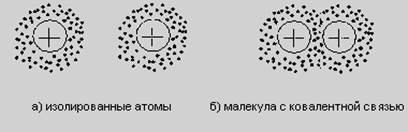
Рисунок 1.3 - Упрощенная схема ковалентной связи в молекуле водорода
Электроны при движении по молекулярной орбите чаще всего находятся между ядрами; где создается как бы избыток отрицательного заряда, что способствует сближению атомов.
Если молекула состоит из одноимённых атомов ( H2,N2,O2,Cl2 ), то электронная пара в одинаковой степени принадлежит обоим атомам. Такую молекулу и существующую в ней ковалентную связь называют неполярной или нейтральной. В неполярных молекулах центры положительных и отрицательных зарядов совпадают. Если же двухатомная молекула состоит из атомов различных элементов, электронная пара может быть смещена к одному из атомов. В этом случае ковалентную связь называют полярной, а молекулы, у которых центры положительных и отрицательных зарядов не совпадают, - полярными или дипольными. Многоатомные молекулы также могут быть неполярными - при симметричном расположении зарядов или полярными - при их асимметричном расположении.
Вещества с ковалентной связью обладают высокой твердостью и хрупкостью. К ним относятся алмаз, кремний, германий, соединения элементов из средних групп таблицы Д.И. Менделеева – SiC,BH. Ковалентные связи характерны и для молекул таких газов, как H2, О2, N2, а также молекул многих органических соединений - полиэтилена (C2 H4) , политетрафторэтилена (С2F4)n, и др. (связи между отдельными молекулами этих соединений - молекулярные).
Ионная связь обусловлена кулоновским притяжением противоположно заряженных ионов. Ионная связь менее прочна, чем ковалентная. К веществам с ионной связью относится большинство солей, (Na – Cl , Li -F ) и некоторые оксиды (Cu2O, Zn0, CdO, Fe2 O3 и др.)
Молекулярная связь- cвязь между отдельными молекулами за счет электростатического притяжения зарядов с противоположными знаками (сил Ван-дер-Ваальса) Природа этих сил сводится к взаимодействий молекулярных диполей, Диполи молекул ориентируются так, что обращенные друг к другу концы соседних диполей разнополярны, и силы притяжения преобладают над силами отталкивания. Эти связи слабые, поэтому .молекулярная связь разрушается при тепловом движении молекул. Вещества с молекулярной связью имеют низкие температуры плавления и кипения (парафин, нафталин и др.).
Дата добавления: 2018-11-26; просмотров: 841;











