АЛИФАТИЧЕСКИЕ АМИНЫ
Реакция с азотистой кислотой позволяет отличить первичные, вторичные и третичные амины.
Первичные амины при взаимодействии с азотистой кислотой вступают в реакцию дезаминирования с образованием спирта.
С2Н5-NН2 + НО-NО ----> С2Н5ОН + N2↑ + Н2О
этиламин этанол
(характерный запах)
Вторичные амины превращаются в нитрозамины (окрашенные соединения).
СН3-NН-СН3 + НО-NО -----> (СН3)2- N-N = О + Н2О
диметиламин диметилнитрозамин
Третичные амины под действием азотистой кислоты практически не изменяются.
Первичные амины при температуре с хлороформом и спиртовой щелочью образуют изонитрилы – вещества с сильным тошнотворным запахом. Данная реакция используется для открытия первичных аминов в фармацевтическом анализе.
СН3 –NН2 + СНС13 + 3NаОН ----> СН3-N ≡ С + 3NаОН +3Н2О
метиламин метилизонитрил
(запах)
Амины встречаются в природе повсеместно в виде витаминов, гормонов, промежуточных продуктов обмена, есть они и в организме животных и в растениях. Кроме того, при гниении живых организмов также получаются средние амины, которые в жидком состоянии распространяют неприятный запах селедочного рассола.
АЛЬДЕГИДЫ
Альдегиды легко окисляются в соответствующие карбоновые кислоты. Для их окисления можно использовать различные окислители. Одной из качественных реакций для обнаружения альдегидной группы является реакция «серебряного зеркала» - окисление реактивом Толленса. Катион серебра восстанавливается в свободное серебро. На стенках пробирки появляется налет металлического серебра в виде зеркала.
Т*
СН3-С(О)Н + 2Аg(NН3)2ОН -------> СН3СООNН4 + 2Аg↓ + 3NН3 + Н2О
уксусный ацетат
альдегид аммония
Аg + +1е ---> Аg 2 окислитель
С+ - 2е ---> С+3 1 восстановитель
Другая качественная реакция на альдегиды заключается в окислении их гидроксидом меди (+2). При окислении альдегида гидроксид меди (+2), имеющий светло-голубой цвет, восстанавливается в гидроксид меди (+1) желтого цвета. Этот процесс протекает при комнатной температуре. Если подогреть испытуемый раствор, то гидроксид меди (+1) желтого цвета превращается в оксид меди (+1) кирпично-красного цвета, который плохо растворим в воде и выпадает в осадок.
Т*
СН3- С(О)Н + 2Сu (ОН)2 ------> СН3 - СООН + 2СuОН↓ + Н2О
С+1 -2е ---> С+3 1 восстановитель
Сu+2 + 1е ---> Сu+1 2 окислитель
Т*
2СuОН↓-------> Сu2О↓ + Н2О
С реактивом Несслера в щелочной среде из альдегида образуется соответствующая карбоновая кислота, в результате этой реакции выпадает в осадок восстановленная ртуть серо-черного цвета.
СН3- С (О) Н + [К2Нg]I4 +3 КОН ---> СН3СООК + Нg↓ + 4КI +2Н2О
С+1 – 2е ---> С+3 1 восстановитель
Нg+2 +2е---> Нg 1 окислитель
Также проводят реакцию с реактивом Фелинга , при нагревании реакционной смеси постепенно выпадает осадок оксида меди (+1) кирпично –красного цвета.
СН3-С(О)Н+2NаООС-СН-СН-СООК+3Н2О--->СН3СООН + 2NаООС-СН- СН-СООК+
| | | |
О О ОН ОН
\ /
Сu сегнетова соль
(тартрат калия-натрия)
+ Сu2О↓ + Н2О
С+1 – 2е ---> С+3 1 восстановитель
Сu+2 +1е ---> Сu+1 2 окислитель
Для альдегидов (и кетонов) можно предложить качественную реакцию – реакцию образования оснований Шиффа, окрашенных соединений. Реакцию проводят с аммиаком и производными аммиака (гидразин, фенилгидразин, гидроксиламин, амины).
СН3 –С (О) Н + NН3 -------> СН3- СН=NН + Н2О
уксусный имин этаналя,
альдегид, основание Шиффа
этаналь
СН3 –С (О) Н + NН2- NН2 -----> СН3- СН=N-NН2 + Н2О
гидразин гидразон этаналя,
основание Шиффа
СН3- С (О) Н + NН2-NН-С6Н5 -----> СН3 –СН=N-NН-С6Н5 + Н2О
фенилгидразин фенилгидразон этаналя,
основание Шиффа
СН3- С (О) Н + NН2-С2Н5 ----> СН3- С=N-С2Н5 + Н2О
этиламин этилимин этаналя,
основание Шиффа
СН3 –С (О) Н + NН2-ОН -----> СН3- СН=N-ОН + Н2О
гидроксиламин оксим этаналя,
основание Шиффа
Многие лекарственные препараты и биологические соединения содержат оксогруппу.
Формальдегид (формалин) – применяют для дезинфекции. Так как формалин предотвращает разложение, он используется в качестве бальзамирующего средства для длительного хранения биологических препаратов. Из формальдегида получают метенамин (гексаметилентетрамин, уротропин).
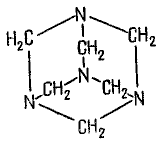
Метенамин применяют как противовоспалительное средство при заболевании мочевой системы. Широкое применение в медицине имеет глюкоза – общеукрепляющее, в составе растворов кровезамещающих, плазмозамещающих, дезинтоксикационных электролитов, а также для улучшения вкуса препаратов.
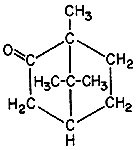 Камфора (1,7,7-триметилбицикло-[2.2.1]-гептан-2-он) распространена в природе, входит в состав многих эфирных масел. Особенно много её в масле камфорного лавра, базилика, полыней, розмарина. В медицине применяют d- и L- камфору; рацемическую камфору допускают лишь для наружного применения из-за повышенной токсичности ввиду химического загрязнения. При введении под кожу растворы камфоры в растительном масле тонизируют дыхательный центр, стимулируют сосудодвигательный центр. Оказывает также непосредственное действие на сердечную мышцу, усиливая обменные процессы в ней и повышая её чувствительность к влиянию симпатических нервов. Под влиянием камфоры суживаются периферические кровеносные сосуды. Способствует отделению мокроты. Возможно, что камфора ингибирует агрегацию тромбоцитов, в связи с чем она рекомендована к применению для улучшения микроциркуляции. Противозудное действие камфоры, возможно, связано с тем, что она, как и ментол, избирательно активирует холодовые рецепторы.
Камфора (1,7,7-триметилбицикло-[2.2.1]-гептан-2-он) распространена в природе, входит в состав многих эфирных масел. Особенно много её в масле камфорного лавра, базилика, полыней, розмарина. В медицине применяют d- и L- камфору; рацемическую камфору допускают лишь для наружного применения из-за повышенной токсичности ввиду химического загрязнения. При введении под кожу растворы камфоры в растительном масле тонизируют дыхательный центр, стимулируют сосудодвигательный центр. Оказывает также непосредственное действие на сердечную мышцу, усиливая обменные процессы в ней и повышая её чувствительность к влиянию симпатических нервов. Под влиянием камфоры суживаются периферические кровеносные сосуды. Способствует отделению мокроты. Возможно, что камфора ингибирует агрегацию тромбоцитов, в связи с чем она рекомендована к применению для улучшения микроциркуляции. Противозудное действие камфоры, возможно, связано с тем, что она, как и ментол, избирательно активирует холодовые рецепторы.
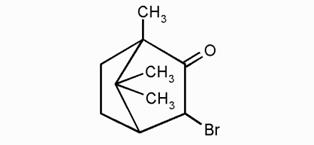 Бромкамфора (2-бромо-4,7,7-триметилбицикло[2.2.1]гептан-3-он) – синтетический препарат, основное действующее вещество которого — камфора бромистая. Оказывает успокаивающее действие на центральную нервную систему, благоприятно влияет на функции сердечно-сосудистой системы, улучшает сердечную деятельность.
Бромкамфора (2-бромо-4,7,7-триметилбицикло[2.2.1]гептан-3-он) – синтетический препарат, основное действующее вещество которого — камфора бромистая. Оказывает успокаивающее действие на центральную нервную систему, благоприятно влияет на функции сердечно-сосудистой системы, улучшает сердечную деятельность.
КАРБОНОВЫЕ КИСЛОТЫ
Все карбоновые кислоты в водном растворе диссоциируют на ионы, окрашивают лакмус в красный цвет и метиловый оранжевый в розовый цвет (рН < 7), фенолфталеин и тимолфталеин окраску не изменяют в кислой среде.
Для всех карбоновых кислот характерна реакция этерификации - взаимодействие со спиртами.
Т*, Н2SО4 конц.
СН3-СООН + С2Н5ОН---------------------------> СН3- С (О)-ОС2Н5 + Н2О
уксусная этанол этиловый эфир
кислота уксусной кислоты
(фруктовый запах)
Муравьиная кислота обладает восстановительными свойствами, что и используют в качественном анализе. Реакцию проводят с реактивом Толленса при нагревании, в результате реакции появляется восстановленное серебро (на стенках пробирки металлическое серебро в виде зеркала).
Т*
НСООН +2Аg(NН3)2ОН --------> 2Аg ↓+4NН3↑ +СО2↑ + 2Н2О
Аg+ + 1е ----> Аg 2 окислитель
С+2 – 2 е ----> С+4 1 восстановитель
Уксусную кислоту и ее соли определяют раствором хлорида железа (III). В результате реакции образуется ацетат железа (+3) – раствор красно-бурого цвета.
3СН3 –СООNa + FeC13 -----> (CH3 –COO)3 Fe + 3NaC1
ацетат железа (+3)
Качественную реакцию на бензойную кислоту проводят в слабощелочной среде, в результате образуется основной бензоат железа (+3) - осадок розово-желтого цвета.
С6Н5-СООН + NаОН ----> С6Н5 –СООNа + Н2О
1 кап.
6С6Н5- СООNa + 2FeC13 + 10 H2O ----> (C6H5 –COO)3Fe Fe(OH)3 *7H2O↓
основной бензоат железа (III)
+ 3C6H5-COOH + 6NаС1
Реакцию нельзя проводить в щелочной среде (образуется бурый осадок гидроксид железа (+3)), нельзя проводить в кислой среде (в осадок белого цвета выпадает бензойная кислота).
Дата добавления: 2021-01-11; просмотров: 534;











