ЭМИССИОННЫЙ СПЕКТРАЛЬНЫЙ АНАЛИЗ
Методы эмиссионного спектрального анализа широко используются во многих областях науки и техники и в различных отраслях промышленности. Наиболее широкое применение эмиссионный анализ получил в металлургической промышленности, в анализе рудных полезных ископаемых, материалов электронной техники. В настоящее время эмиссионный спектральный анализ играет существенную роль и в анализе природных и сточных вод, почвы и других объектов.
Под эмиссионным спектральным анализом понимаются методы определения химического состава вещества по наблюдению его возбужденного спектра. Для этого необходимо перевести анализируемое вещество в атомарное возбужденное состояние путём его нагревания до высокой температуры (1000 – 5000 оС). Источниками тепла могут быть электрическая дуга, искра или высокотемпературное пламя. При этом происходит переход внешних валентных электронов с основного энергетического уровня Е0 на более высокие энергетические уровни. Это соответствует переходам Е0 → Е1, Е0 → Е2,…. Е0 →Еn. Состояние электронов на возбуждённых уровнях неустойчиво и продолжается 10–6 – 10–8 с, затем происходит возврат электронов на основной уровень или на промежуточные уровни, сопровождающийся выделением энергии. Этот процесс соответствует переходам Е1 → Е0, Е2 → Е0, Е2 → Е1 и т. д. Освобождающаяся при таких переходах энергия излучается в виде световых квантов. Каждый акт соответствует излучению одной спектральной линии.
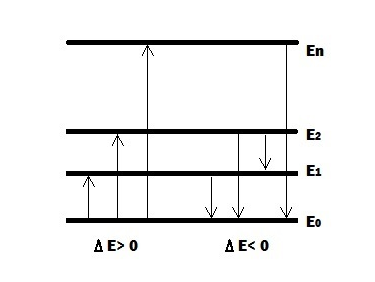
Рисунок 1.1 – Схема электронных уровней атомов
Согласно постулату Бора излучение энергии атомами квантовано и определяется соотношением
ΔЕ = Еn - Е0 = hν = hC/λ,
где Еn и Е0– энергия электронов до и после излучения,h – постоянная Планка, ν – частота излучения, С – скорость света, λ– длина волны излучения. Частота получающегося излучения равна
ν = (Еn–Е0)/h.
При возбуждении паров анализируемого вещества в высокотемпературном источнике наблюдаются линейчатые и полосатые спектры. Линейчатые спектры обязаны своим появлением переходам электронов между энергетическими уровнями возбужденных атомов и ионов. Дискретный характер спектров связан с квантовым характером уровней. Полосатые спектры принадлежат молекулам, присутствующим в разряде, и являются результатом возбуждения электронных, колебательных или вращательных уровней молекул.
Излучение атомов с помощью спектральных приборов разлагается в эмиссионный спектр – набор отдельных спектральных линий. Каждая спектральная линия соответствует определённому переходу электронов и характеризуется частотой или длиной волны, а также интенсивностью излучения. Для аналитических целей используют наиболее интенсивные резонансные линии, соответствующие переходу Е0 → Е1. Эти линии называют аналитическими или последними, так как при уменьшении концентрации определяемого элемента они исчезают в его спектре в последнюю очередь. Эмиссионные спектры наблюдаются в видимой и ультрафиолетовой области электромагнитных волн, так как энергия переходов внешних электронов соответствует энергии видимого и УФ-излучения (от 150 до 800 нм).
Качественный спектральный анализ основан на определении длин волн отдельных спектральных линий, характерных для каждого элемента, и отнесении их к конкретным атомам анализируемого вещества. Для этого используют атласы или таблицы спектральных линий. Определение длины волны аналитических линий элементов проводится путём сравнения спектра анализируемого вещества со спектром железа, который содержит большое число линий в разных областях спектра, отнесённых к определённым длинам волн. Идентификация элементов проводится по трём последним линиям. Однако не все эти линии пригодны для использования, так как некоторые из них лежат в труднодоступной области спектра (200 нм) или в области малой чувствительности фотопластины. В этих случаях вместо последних линий используют другие, менее чувствительные линии.
Количественный спектральный анализ основан на измерении интенсивности одной из аналитических линий и сравнении её с интенсивностью такой же линии в спектре эталонного образца определяемого элемента. Интенсивность спектральных линий, т.е. интенсивность излучения, зависит от концентрации определяемого элемента: I = a · C.
Эта зависимость сложным образом определяется многими факторами (валовый состав проб, их структура, дисперсность, параметры источника возбуждения спектров, нестабильность регистрирующих устройств, свойства фотопластинок). Поэтому, как правило, для её установления используют набор образцов для градуировки, которые по валовому составу и структуре возможно более близки к анализируемому веществу и содержат известные количества определяемых элементов.
Дата добавления: 2021-05-28; просмотров: 654;











