Физико-химические основы электрохимической обработки
В основе электрохимической обработки (ЭХО) лежат окислительно-восстановительные процессы, протекающие на электродах, помещённых в электролит, при пропускании через электролит постоянного электрического тока. В совокупности эти процессы называют электролизом. Электролитами при ЭХО являются водные растворы: солей (NaCl, NaNО3, Na2SO4, KСl и др.), кислот (HCl, H2SO4, HNO3 и др.), щёлочей (NaOH, KOH и др.).
В качестве примера далее рассмотрены процессы, проходящие при электролизе в водном растворе хлорной меди CuCl2 с анодом из меди (рис. 1.64).
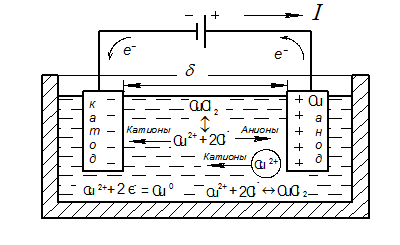
Рис. 1.64. Схема электролиза меди в растворе CuCl2
В воде молекулы хлорной меди диссоциируют на ионы по следующей схеме: CuCl2 « Cu2+ + 2Cl–. При создании на электродах от источника питания разности потенциалов анионы хлора начинают двигаться к аноду, а катионы меди – к катоду. Электрическая цепь (источник питания — электрод-катод — электролит — электрод-анод — источник питания) при этом замыкается.
Источник питания начинает перемещать электроны с анода во внешнюю цепь. Отдав электроны, атомы меди в виде ионов переходят в электролит. Происходит растворение материала анода. Подошедшие к катоду катионы меди присоединяют электроны из внешней цепи и осаждаются в атомарном виде на катоде, формируя покрытие. Фактически происходит перенос атомов меди с анода на катод.
На катоде осуществляется процесс восстановления меди, т. е. присоединения электронов, а на аноде — окисления, т. е. отдача электронов.
В целом электролиз водного раствора CuCl2 при медном аноде можно представить в виде следующей схемы:
CuCl2 ↔ Cu2+ + 2Cl–
Катод: Cu2+, Н2О Анод (Cu): Cu, Cl–, Н2О

 Cu2+ + 2е– = Сu0↓ Cu0 - 2 e– = Cu2+ (переходят в раствор).
Cu2+ + 2е– = Сu0↓ Cu0 - 2 e– = Cu2+ (переходят в раствор).
Физико-химические процессы, протекающие при электролизе, легли в основу электрохимических методов обработки заготовок. Так, растворение материала анода стало предпосылкой создания группы методов электрохимической размерной обработки, полирования, комбинированных методов, а осаждение металла на катоде стало основой получения электрохимических покрытий на заготовках.
Процессы, проходящие при электролизе на электродах и в растворе, зависят как от состава электролита, так и от материалов, из которых сделаны электроды. Основные соотношения, описывающие электролиз, установлены и сформулированы в 1833–1834 годах английским учёным М. Фарадеем. Согласно объединённому закону М. Фарадея масса вещества, окисленного на аноде и восстановленного на катоде (m, кг) прямо пропорциональна количеству прошедшего через электролит электричества. Этот закон выражается следующей математической формулой:
m = kэхq = kэхIt, (1.56)
где kэх — электрохимический эквивалент вещества, кг/Кл; q — количество электричества, Кл; I — сила тока, А; t — время протекания процесса, с. Коэффициент kэх численно равен массе вещества в килограммах, растворённого (перемещённого с анода на катод) при I = 1 А за одну секунду.
Фактическая масса вещества, прореагировавшего при электрохимической обработке на аноде, всегда меньше массы, вычисленной по закону Фарадея. Это объясняется тем, что часть количества электричества тратится на побочные реакции на электродах, образование газов, прохождение вторичных реакций в электролите. Эту разницу оценивают коэффициентом выхода по току kη:
kη = mф / m , (1.57)
где mф — фактическая масса растворённого вещества, кг.
Значение kη для разных процессов варьируется в широких пределах и зависит от условий, при которых реализуется процесс электролиза; загрязнений электролита продуктами реакций, температуры электролита, плотности тока и других параметров процесса.
С учётом значения kη фактическую массу растворённого при электрохимической обработке металла заготовки mф, кг, определяют по формуле
mф = 60kηkэхItо, (1.58)
где tо – основное время электрохимической обработки, мин.
Ввиду большого числа факторов, влияющих на коэффициент kh, найти его значение теоретическим путём не удаётся. Поэтому на практике выход по току определяют экспериментально через отношение
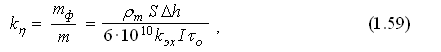
где rm — плотность материала анода, кг/м3; S — площадь анода, подлежащая обработке, мм2; Δh — толщина растворённого слоя металла анода, мм.
Скорость электрохимического растворения υр в линейных единицах (мм/мин), может быть определена следующим образом:
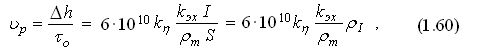
где rI — плотность тока, А/мм2.
Непосредственные расчеты υр по формуле (1.60) провести не удаётся, так как с увеличением плотности тока падает значение выхода по току. При этом наблюдается рост удельной энергоёмкости процесса, значение которой wm, Дж/кг, рассчитывают по формуле:
wm = 60IUtо /mф, (1.61)
где U — напряжение на электродах, В.
Из формулы (1.61) следует, что удельная энергоёмкость wm процесса ЭХО с возрастанием силы тока I увеличивается. Росту wm способствует ещё и то, что одновременно с ростом силы тока падает выход по току.
В лабораторной работе исследуются охарактеризованные выше зависимости технико-технологических характеристик ЭХО от плотности тока kη = f1(ρI), υр = f2(ρI), wm = f3(ρI), которые для заданного в работе диапазона режимов электрохимической размерной обработки соответствуют типовым графикам, приведённым на рисунке 1.65.
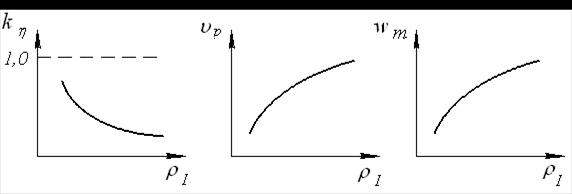
Рис. 1.65. Типовые графики зависимостей параметров электрохимического травления заготовки от плотности тока
Содержание работы
Работа включает изучение технологических характеристик и основных закономерностей электрохимической размерной обработки, проведение эксперимента с построением графиков зависимостей выхода по току, скорости анодного растворения и удельной энергоёмкости электрохимической обработки плоской поверхности заготовки от плотности тока и выполнение индивидуального задания.
Дата добавления: 2021-05-28; просмотров: 494;











