Четыре фактора неустойчивости алициклических конформеров
Устойчивость как и неустойчивость конформеров алициклических соединений определяют 4 фактора:
1) Первый фактор - Байеровское напряжение – это напряжение, обусловленное отклонением от тетраэдрического угла при условии плоского строения цикла, или напряжение, обусловленное искажением валентных углов. Эта теория известна как теория напряжения Байера. А. Байер считал данный фактор напряжения единственным, определяющим прочность цикла.
Для объяснения различной устойчивости циклических систем А. Байер в 1885 г. предложил теорию, применимую к трех-, четырех- и пятичленным циклам. Согласно этой теории в тех циклических соединениях, в которых направление валентных связей отклоняется от тетраэдрического угла (109028'), возникает напряжение, причем это напряжение будет тем больше, чем больше отклонение. Последнее определяется значением угла, вычисляемым как половина разности между 109028' и значением внутреннего угла правильного многоугольника.
Например, для трехчленного цикла этот угол будет равен:




 109028' – 600
109028' – 600

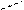

 24044' 600 24044' = + 24044'
24044' 600 24044' = + 24044'

 У четырехчленного цикла байеровское напряжение равно:
У четырехчленного цикла байеровское напряжение равно:


 9044'
9044'

 900 109028' – 900
900 109028' – 900
 = + 90 44'
= + 90 44'

 9044'
9044'
У пятичленного цикла отклонение от тетраэдрического угла равно:



 109028' – 1080
109028' – 1080




 = 0044'
= 0044'
 0044' 1080 0044' 2
0044' 1080 0044' 2
У шестичленного цикла напряжение Байера равно:






 109028' – 1200
109028' – 1200
 1200 = – 5025'
1200 = – 5025'
Следовательно, по Байеру напряжение циклов уменьшается от трехчленного (наиболее напряженного) к пятичленному, а затем вновь возрастает при условии плоского строения циклов. Однако в действительности этого нет – макроциклические соединения относительно инертны, особенно к реакциям присоединения.
Исследования показали, что, начиная с циклогексана, циклы имеют неплоское строение, их валентные углы не отклоняются от тетраэдрического угла, и в них отсутствует байеровское напряжение.
В 1890 году Заксе указал на то, что соединения, содержащие большие циклы, не обязательно должны быть плоскими, поскольку напряжение может быть устранено при нарушении плоского строения. Это положение было развито Мором в 1918 году и получило название теории ненапряженных больших циклов Заксе – Мора.
О напряжении в циклах судят по теплоте сгорания циклических соединений. Теплота сгорания, приходящаяся на одну группу (–СН2-) , наименьшая для циклогексана. Если напряжение в этом цикле принять за нуль, то в трехчленном цикле оно составит 38,1 кДж на 1 группу (-СН2-), а в пятичленном – 5,4 кДж. В циклах с n>6 величина напряжения меняется от 0 до 6 кДж.
Значения напряжений циклов, определенные по теплоте сгорания группы (–СН2–), представлены в таблице. Малые циклы имеют повышенный запас энергии по сравнению с другими циклами, которые по энергии приближаются к алканам (см. таблицу). Это свидетельствует об отсутствии байеровского напряжения в циклах, начиная с циклопентана.
Таблица
| Размер кольца | Теплота сгорания на (-СН2-)-группу, Ккал/моль |
| алканы СnH2n+2 | 157,4 |
| циклопропан | 166,6 |
| циклобутан | 164,0 |
| циклопентан | 158,7 |
| циклогексан | 157,4 |
| циклононан | 158,8 |
| циклододекан | 157,6 |
| циклотетрадекан | 157,4 |
Из таблицы видно, что у алканов, циклогексана и циклотетрадекана значения теплот сгорания на (-СН2-)-группу одинаковые, то есть это подтверждает, что указанные соединения не имеют плоского строения. Таким образом, напряженными циклами являются только трех- и четырехчленные циклы, а у других циклов байеровского напряжения, как такового, нет.





 Заксе утверждал, что если имеются две модели циклического соединения, то их можно разделить. Например, циклогексан имеет конформации «кресло» и «ванна»:
Заксе утверждал, что если имеются две модели циклического соединения, то их можно разделить. Например, циклогексан имеет конформации «кресло» и «ванна»:






«кресло» «ванна»
Немецкий ученый Мор продолжил учение Заксе и показал, что можно построить две модели бицикла декалина – цис- и транс- формы, которые в дальнейшем можно будет разделить:

 Н Н
Н Н
 |  |  |





















 |  |
Н Н
декалин или цис-декалин транс-декалин
бицикло[4.4.0]декан





 Н Н
Н Н














 Н
Н





Н
цис-декалин транс-декалин
Хюккель, продолжая исследования Заксе и Мора по циклам, на практике получил и разделил декалин на два изомера. Отсюда делается вывод, что если бы циклогексан был только в плоской конформации, то декалин, состоящий из двух колец циклогексана, должен иметь только один изомер – и это был бы цис-декалин. На самом деле модель циклогексана является неплоской, где оба кольца находятся либо в виде «кресла-конформации», либо в виде «ванны-конформации».
2) Второй фактор – Торсионное напряжение или напряжение Питцера представляет собой отклонение от энергетически более выгодной «заторможенной конформации» (вращение вокруг σ-связи).
В плоских циклах водородные атомы или группы атомов должны находиться в менее выгодной «заслоненной конформации», где взаимное отталкивание атомов будет максимальным. Напряжение Питцера связано с изменением двугранных углов из-за заслоненного расположения связей между двумя смежными атомами углерода. (друг против друга).
Например, в циклопентане, молекула которого имеет почти плоскую форму, питцеровское напряжение довольно высокое, так как связи между углеродными атомами в цикле находятся друг против друга. А в циклогексане напряжение Питцера равно нулю, то есть система циклогексана является неплоской:






 |  |  |

циклопентан циклогексан
У циклогексана существуют конформации «кресло» и «ванна».
 | 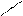 | 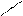 | |||||||
 |  | ||||||||
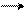











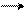






Проекция Ньюмена «кресло» напоминает Проекция Ньюмена «ванна» напоминает
заторможенную конформацию этана. заслоненную конформацию этана
(торсионное напряжение минимальное) (торсионное напряжение максимальное)
Между формами «кресло» и «ванна» возможны переходы, на больше циклогексан существует в форме «кресло».
У циклопентана при плоском цикле отсутствует угловое напряжение или напряжение Байера, но усиливается торсионное напряжение, так как атомы водорода находятся в заслоненном положении, что энергетически не выгодно. Поэтому атомы углерода стремятся выйти из плоскости цикла, выигрывая энергию в целом, которая обусловливает устойчивость цикла:



 Н Н
Н Н






 Н Н Н Н
Н Н Н Н

 Н
Н
Н Н
Н
плоская конформация циклопентана неплоская конформация циклопентана «конверт»
(угловое напряжение минимальное, (угловое напряжение усиливается, торсионное
торсионное – максимальное) уменьшается)
У циклобутана угловое напряжение очень большое, как и торсионное, потому что кольцо находится в заслоненной конформации. Напряжение как угловое, так и торсионное частично снимается за счет неплоского кольца:


 Н
Н





 Н Н
Н Н






 Н 300
Н 300
 Н
Н
Н Н
Н
заслоненная конформация циклобутана неплоская конформация циклобутана
В плоской конформации находится только циклопропан.
Напряжение Питцера оказывает заметное влияние на направление атаки тригонального атома углерода. Например, аксиальная атака на циклогексанон более благоприятна, чем экваториальная, так как полученное соединение с экваториальной связью НО-группы приобретает менее заслоненную конформацию. При экваториальной атаке реагентом плоского атома углерода получают продукт реакции, где НО-группа расположена аксиально, и в этом случае полученный спирт приобретает более заслоненную конформацию, что энергетически не выгодно:


 аксиальная атака Х О Х
аксиальная атака Х О Х











 ОН
ОН
 | |||||
 |  | ||||
 Н Н
Н Н
Н Н
экваториальный спирт
(менее заслоненная конформация)






 О Н ОН
О Н ОН





 Н Х
Н Х






 Х экваториальная атака
Х экваториальная атака
 |  |
Н
Н
аксиальный спирт
(более заслоненная конформация)
3) Напряжение, связанное с ван-дер-ваальсовым взаимодействием. Это напряжение связано с отталкиванием сближенных атомов (вицинальных) на расстоянии ван-дер-ваальсовых радиусов.
 | |||
 | |||

 Х У
Х У



4) Напряжение, связанное с трансанулярным эффектом, или трансанулярное напряжение (напряжение Прелога). Это напряжение обусловлено изменением межатомных расстояний, связанных с трансанулярным взаимодействием или взаимодействием атомов через кольц. Чаще всего это взаимодействие происходит при 1,3 - , 1,4 – 1,5 – и 1,6 – положениях атомов. Трансанулярный эффект проявляется особенно ярко у соединений с размером колец 8 – 12 – членными и является причиной внутримолекулярной циклизации этих циклоалканов.
Атомы, находящиеся на противоположных сторонах кольца среднего размера, могут быть настолько сближены, что становится возможным ван-дер-ваальсовое отталкивание, то есть возникает напряжение Прелога или трансанулярное напряжение:









 Н Н Н Н
Н Н Н Н













 Н Н
Н Н
 |  |  |




 Н Н
Н Н


 Н Н
Н Н
Н Н
1,3 – взаимодействие атомов 1,5 – взаимодействие атомов
«через поле» «через поле»
Из рисунка видно, что три атома водорода над кольцом и под кольцом располагаются особенно близко друг от друга. Это приводит к неустойчивости средних циклов, а также к аномальным реакциям.
Например, кислотный гидролиз α-окиси циклодецена. При размыкании α-окиси циклодецена под действием протона образуется карбокатион (I), который, гидролизуясь, должен образовать продукт гидролиза 1,2 – диол. На практике получается, в основном, 1,6 – диол, а диол – 1,2 отсутствует. Это объясняется трансанулярным эффектом, а именно, взаимодействием сближенных атомов водорода «через поле» и образованием второго карбокатионного центра (II). Именно карбокатион (II) гидролизуется и образует 1,6 – диол:

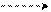







 (СН2)3 – С – Н Н+ (СН2)3 – С – Н (СН2)3 – С+–Н
(СН2)3 – С – Н Н+ (СН2)3 – С – Н (СН2)3 – С+–Н



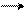




 Н – С – Н О׃
Н – С – Н О׃ 
 Н – С – Н О+–Н Н-С – Н
Н – С – Н О+–Н Н-С – Н
 (СН2)4 – С – Н (СН2)4– C – Н (СН2)4 – СН-ОН
(СН2)4 – С – Н (СН2)4– C – Н (СН2)4 – СН-ОН
α – окись циклодецена оксониевый ион карбокатион(I)
α – окиси циклодецена (переход гидрид-иона-
 - трансанулярное взаимодействие)
- трансанулярное взаимодействие)
 НОН
НОН



 (СН2)3 – СН2 НОН (СН2)3 – СН2
(СН2)3 – СН2 НОН (СН2)3 – СН2



 Н-С+ НО – СН (СН2)3– СН–ОН
Н-С+ НО – СН (СН2)3– СН–ОН
 (СН2)4 – СН – ОН (СН2)4 – СН – ОН СН2
(СН2)4 – СН – ОН (СН2)4 – СН – ОН СН2
карбокатион (II) 1,6 – диол циклодецена (СН2)4 – СН–ОН
(практически) 1,2-диол циклодецена
(теоретически)
ЦИКЛОПРОПАН
Циклопропан существует только в одной плоской конформации (три точки всегда лежат в одной плоскости). По теории Байера искажение валентных углов при sp3-гибридизации орбиталей углеродных атомов должно составлять: (109°28' – 60°) ׃ 2 = 24°44', то есть циклопропан является самой напряженной циклической системой.
В действительности угол между связывающими орбиталями углеродных атомов составляет около 104°. Согласно квантово-механическим представлениям изменение угла является результатом изменения гибридизации атомов углерода. При этом меньшее перекрывание орбиталей с избытком компенсируется уменьшением напряжения системы. Поэтому гибридизация орбиталей в молекуле циклопропана ближе к sp2-гибридизации алкенов, чем к sp3-гибридизации алканов. Подобные связи называются τ (тау)-связями или «банановыми», то есть похожие по форме на бананы.
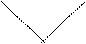
Наряду с σ, π – описанием химических связей, которое не является единственно возможным, существует τ – описание С-С-связей. Тау (τ) описание С – С-связей следующее: при описании sp2-гибридизации, например, у этилена, присутствует набор трех sp2-гибридных орбиталей и одна р-негибридная орбиталь. Если этот набор орбиталей регибридизировать, то получится новый набор орбиталей, при перекрывании которых получаются две эквивалентные С – С- связи. Эти связи называют связями τ-типа. Они представлены двумя орбиталями, имеющими форму банана, которые соединяют углеродные атомы, образующие двойную связь:
 | |||||||||
 | |||||||||
 |  |  | |||||||






 + 1040
+ 1040
sp2 -орбиталь p-орбиталь (sp2+p)-орбитали 2 τ-орбитали
 τ-связь τ-связь
τ-связь τ-связь






 Н Н Н Н
Н Н Н Н
 | |||||
 | |||||
 | |||||


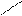


 С С С С
С С С С
 | |||
 | |||
Н Н Н Н
 τ-связь τ-связь
τ-связь τ-связь
этилен
У циклопропана три С – С –банановые или τ-связи, а связи С – Н близки к sp2-гибридизации.





 Н Н
Н Н





 С
С



 104° τ-связь τ-связь
104° τ-связь τ-связь



 НН
НН

 220 С С
220 С С



 60° 104°
60° 104°



 220 Н Н
220 Н Н
τ-связь
близко к sp2-гибридизации
Электронографические характеристики циклопропана:


 СН2
СН2


 1040 116,40 Н
1040 116,40 Н



 Н2С С 1180
Н2С С 1180
0,154 нм Н
Иначе можно сказать, что С – С-связи в циклопропане по своей природе являются промежуточными между ординарными и двойными связями.
Характер τ и σ, π – представлений таков, что они должны рассматриваться как эквивалентные. Тау-модели воспроизводят строение молекулы, а сигма, пи – описание химических связей ценно для количественных расчетов.
Тау-связи встречаются и у ацетилена, у которого три τ (С-С)-связи:
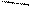

 Н – С С – Н
Н – С С – Н
Дата добавления: 2017-01-16; просмотров: 3322;











