Законы электролиза Фарадея
Первый закон Фарадея. Количество вещества, выделившегося на каждом из электродов при электролизе, пропорционально заряду, протекшему через электролит:
m=k∙I·Δt.
В 1832 году Фарадей установил, что масса m вещества, выделившегося на электроде, прямо пропорциональна электрическому заряду q, прошедшему через электролит:
q=k·I·t,
Коэффициент пропорциональности k –называется электрохимическимэквивалентом вещества. Он численно равен массе вещества, выделившегося при прохождении через электролит единичного электрического заряда, и зависит от химической природы вещества.
I – ток протекающий через электролит за время 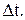
Второй закон Фарадея. Электрохимический эквивалент всех веществ пропорционален их химическому эквиваленту:
k = F⋅A∙z,
где А- атомный вес;
z - валентность химического элемента;
F - число Фарадея.
Второй закон Фарадея записывается в следующем виде:
m=M⋅I⋅Δtn⋅F,
где M – молярная масса данного вещества, образовавшегося (однако не обязательно выделившегося – оно могло и вступить в какую – либо реакцию сразу после образования) в результате электролиза, г/моль;
I – сила тока, пропущенного через вещество или смесь веществ (раствор, расплав), А; Δt – время, в течение которого проводился электролиз, с;
F – постоянная Фарадея, Кл·моль−1;
n – число участвующих в процессе электронов, которое при достаточно больших значениях силы тока равно абсолютной величине заряда иона (и его противоиона), принявшего непосредственное участие в электролизе (окисленного или восстановленного). Однако это не всегда так; например, при электролизе раствора соли меди(II) может образовываться не только свободная медь, но и ионы меди(I) (при небольшой силе тока).
Выделение вещества на электродах начинается лишь с некоторого напряжения, называемого пороговым напряжением разложения электролита Up. Начиная с этого напряжения, в электролите появляется ток, плотность которого подчиняется закону Ома.
Подвижность ионов зависит от их природы и свойств растворителя. С повышением температуры подвижность ионов возрастает. В электролитах подвижность ионов очень мала. Так, для водных растворов при комнатной температуре она составляет 10-8-10-7 (для сравнения, подвижность электронов в металлах ~10-4).
Законы Фарадея справедливы как для растворов, так и для расплавов и применимы к обоим электродам. Количество электричества, необходимое для образования 1 экв. любого вещества, одинаково для всех веществ; оно равно 96 485 Кл и называется числом Фарадея или постоянной Фарадея (фундаментальная физическая константа). Эта закономерность широко применяется на практике. Исходя из количества затраченного электричества, можно рассчитать массу или толщину металлического покрытия, образующегося при гальваностегии, и наоборот, задав толщину покрытия, можно оценить, какое количество электричества для этого потребуется. Законы Фарадея лежат в основе работы вольтметра и приборов, предназначенных для измерения силы постоянного тока.
Дата добавления: 2019-09-30; просмотров: 984;











