Метастабильные состояния.
Фазовые переходы.
Рассмотрим процесс (равновесный) перехода из одной фазы в другую.
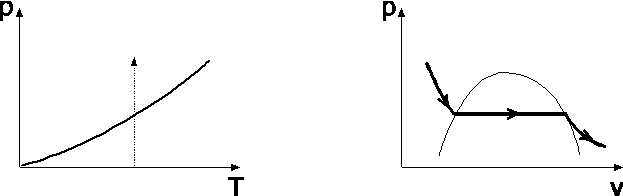 Переход через кривую равновесия изображён на (p,T) и (p,V) плоскостях. Ясно, что проходит через кривую равновесия, на которой
Переход через кривую равновесия изображён на (p,T) и (p,V) плоскостях. Ясно, что проходит через кривую равновесия, на которой 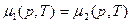 (14)
(14)
Вспомним:
p1=p2 T1=T2
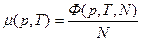 (1)
(1)
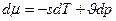
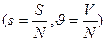
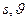 - энтропия и объём на 1 моль (или на одну частицу, нам применять лучше макрочастицу, моль)
- энтропия и объём на 1 моль (или на одну частицу, нам применять лучше макрочастицу, моль)
Отсюда (при N=const):
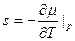
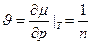 (2)
(2)
n – плотность числа частиц
Так что же меняется при фазовом переходе? Ясно→ 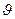 (твёрдое тело – жидкость – газ, очевидно, меняется и s при этом!!!)
(твёрдое тело – жидкость – газ, очевидно, меняется и s при этом!!!)
Фазовые переходы, при которых меняются скачком производные химического потенциала по p и T (равные удельной энтропии и удельному объёму) называются фазовыми переходами первого рода!!!
Изменение энтропии скачком означает, что, например, переход от фазы «1» к фазе «2» сопровождается выделением тепла.
Процесс обратимый, равновесный:
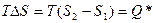 или в расчёте на одну частицу (N=const!!!)
или в расчёте на одну частицу (N=const!!!)
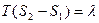 (3), где
(3), где
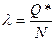 - удельная или молярная (как отнормируем) теплота перехода
- удельная или молярная (как отнормируем) теплота перехода
Таким образом, при фазовых переходах второго рода:
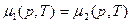 , но
, но
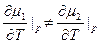
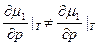 (4)
(4)
Переходы первого рода: испарение, плавление, кристаллизация, возгонка.
Фазовые переходы второго рода. При них производные химического потенциала меняются непрерывно, в (4) ≠ нужно заменить на =. Нет скачков  и s. Но резкие скачки претерпевают вторые производные химического потенциала: теплоёмкость, тепловое расширение, изотермическая сжимаемость.
и s. Но резкие скачки претерпевают вторые производные химического потенциала: теплоёмкость, тепловое расширение, изотермическая сжимаемость.
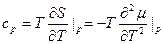
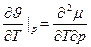 (*)
(*)
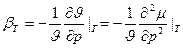
Фазовые переходы второго рода разнообразны. Многие особенности фазовых переходов второго рода присущи фазовым переходам вблизи критической точки.
Вернёмся пока к фазовым переходам первого рода.
Возьмём (14) и продифференцируем по T:
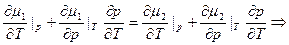
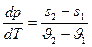 или
или
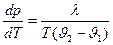 (5) – уравнение Клапейрона-Клаузиуса
(5) – уравнение Клапейрона-Клаузиуса
Оно определяет изменение давления находящихся в равновесии фаз при изменении температуры или (при интегрировании) – кривую равновесия. Та же формула в виде:
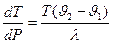 (6)
(6)
Определяет изменение температуры фазового перехода при изменении давления (например, точка замерзания или кипения)
(5) и (6) показывают, что зная уравнение состояния каждой фазы и λ(T), можно найти кривую равновесия p(T).
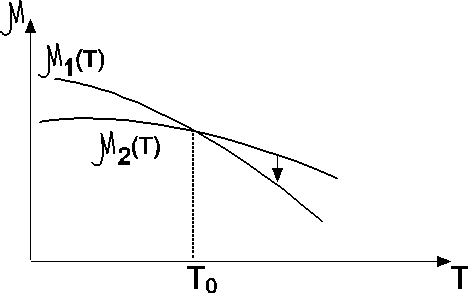
Пусть (см. рис.) p=const, и кривые 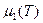 и
и 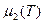 соответствуют разным фазам. При этом
соответствуют разным фазам. При этом 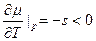 и
и 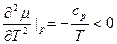 для каждой фазы. Равновесие возможно при
для каждой фазы. Равновесие возможно при 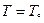 , при остальных T – либо одна, либо другая фаза. Так как при фиксированных p и T устойчива система с minФ, то при
, при остальных T – либо одна, либо другая фаза. Так как при фиксированных p и T устойчива система с minФ, то при 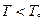 устойчива первая фаза, при
устойчива первая фаза, при 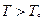 - вторая. (или
- вторая. (или 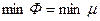 ). Если мы выведем систему из состояния равновесия, повысив температуру обеих фаз, то первая фаза станет неустойчивой, и (как раньше говорили) возникнет поток частиц из первой фазы во вторую (стрелка). s2>s1. Поэтому
). Если мы выведем систему из состояния равновесия, повысив температуру обеих фаз, то первая фаза станет неустойчивой, и (как раньше говорили) возникнет поток частиц из первой фазы во вторую (стрелка). s2>s1. Поэтому 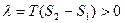 , то есть происходит поглощение тепла, препятствующее повышению температуры.
, то есть происходит поглощение тепла, препятствующее повышению температуры.
Принцип Ле-Шателье: при внешнем воздействии, выводящем систему из равновесия, стимулируются процессы, стремящиеся ослабить результаты этого воздействия и стремящиеся вернуть систему в исходное состояние.
Таким образом, если будем подводить тепло (при p=const), то 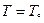 до тех пор, пока всё не перейдёт во вторую фазу, то есть всё будет тратиться на фазовый переход. Процесс пойдёт по красной кривой.
до тех пор, пока всё не перейдёт во вторую фазу, то есть всё будет тратиться на фазовый переход. Процесс пойдёт по красной кривой.
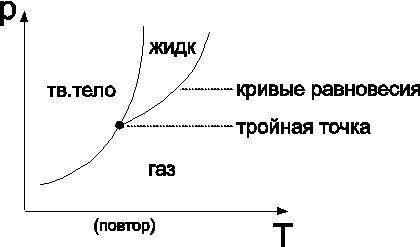
Примеры (следствия (5), (6)):
1)испарение λ>0 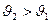 (
( 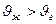 )
)
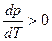
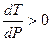 - температура кипения растёт с давлением
- температура кипения растёт с давлением
2) плавление λ>0 и, как правило, 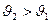 (
( 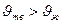 ) как на рис.1, и
) как на рис.1, и 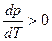 .
.
Но бывает 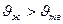 (
( 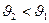 ) и тогда
) и тогда 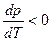 как на рис.1а.
как на рис.1а.
Метастабильные состояния.
Обычная точка фазового перехода не представляет собой особенностей в математическом отношении для термодинамических величин. Можно ожидать, что каждая из фаз может существовать и по другую сторону перехода (см. рис.2). Термодинамические неравенства при этом не нарушаются. Например, изотерма (пусть газ Ван-дер-Ваальса).
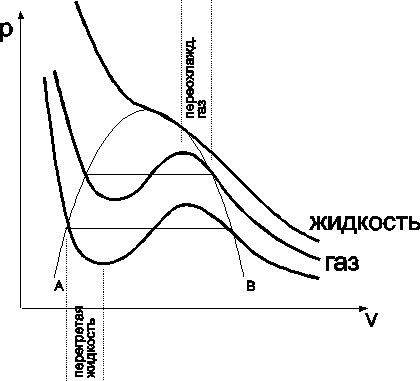
Здесь участки ab и сd – устойчивы, и тело может жить в одной фазе ( 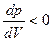 - устойчивость можно показать, исследуя minФ). Участок bc – неустойчив (
- устойчивость можно показать, исследуя minФ). Участок bc – неустойчив ( 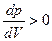 ), а фазовый переход происходит по dl (T=const). Участки изотермы db и cl – как раз и есть те участки, где может существовать перегретая жидкость (db) и переохлаждённый пар (cl). Такие состояния называются метастабильными. Кривая АКВ - геометрическое место точек, где «оканчивается» область существования этих состояний, где неравенства, например,
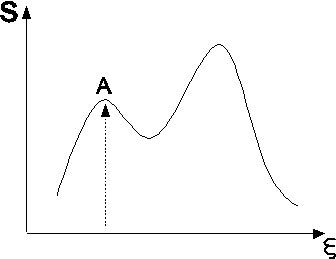
), а фазовый переход происходит по dl (T=const). Участки изотермы db и cl – как раз и есть те участки, где может существовать перегретая жидкость (db) и переохлаждённый пар (cl). Такие состояния называются метастабильными. Кривая АКВ - геометрическое место точек, где «оканчивается» область существования этих состояний, где неравенства, например, 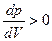 , нарушаются, и тело уже не может существовать как однородное, нужно две фазы. Здесь К – критическая точка. Их относительная устойчивость может определяться отсутствием зародышей другой фазы (пузырьков, капель). Энтропия и другие термодинамические функции имеют в метастабильных состояниях локальные экстремумы.
, нарушаются, и тело уже не может существовать как однородное, нужно две фазы. Здесь К – критическая точка. Их относительная устойчивость может определяться отсутствием зародышей другой фазы (пузырьков, капель). Энтропия и другие термодинамические функции имеют в метастабильных состояниях локальные экстремумы.
Ясно, что maxA устойчив относительно малых флуктуаций, а достаточно большие выведут его из этого состояния (малые пузырьки газа рассасываются, а большие дают старт фазовому переходу).
Дата добавления: 2021-05-28; просмотров: 582;











