Инсулин. Строение, синтез и секреция
Инсулин - полипептид, состоящий из двух полипептидных цепей. Цепь А содержит 21 аминокислотный остаток, цепь В - 30 аминокислотных остатков. Обе цепи соединены
между собой двумя дисульфидными мостиками (рис. 11-23). Инсулин может существовать в нескольких формах: мономера, димера и гек-самера. Гексамерная структура инсулина стабилизируется ионами цинка, который связывается остатками Гис в положении 10 В-цепи всех 6 субъединиц.
Молекула инсулина содержит также внутримолекулярный дисульфидный мостик, соединяющий шестой и одиннадцатый остатки в А-цепи. Инсулины некоторых животных имеют значительное сходство по первичной структуре с инсулином человека.
Бычий инсулин отличается от инсулина человека по трём аминокислотным остаткам, а инсулин свиньи отличается только на одну аминокислоту, которая представлена алани-ном вместо треонина на карбоксильном конце В-цепи.
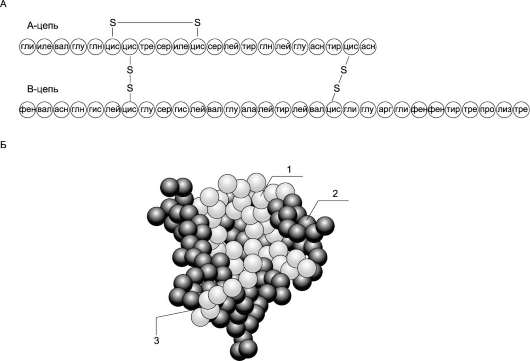
Рис. 11-23. Структура инсулина человека.А. Первичная структура инсулина. Б. Модель третичной структуры инсулина (мономер): 1 - А-цепь; 2 - В-цепь; 3 - участок связывания с рецептором.
В обеих цепях во многих положениях встречаются замены, не оказывающие влияния на биологическую активность гормона. Наиболее часто эти замены обнаруживаются в положениях 8, 9 и 10 цепи А.
В то же время в положениях дисульфидных связей, остатков гидрофобных аминокислот в С-концевых участках В-цепи и С- и N-кон-цевых остатков А-цепи замены встречаются очень редко, что свидетельствует о важности этих участков для проявления биологической активности инсулина. Использование химических модификаций и замен аминокислот в этих участках позволили установить структуру активного центра инсулина, в формировании которого принимают участие остатки фенила-ланина В-цепи в положениях 24 и 25 и N- и С-концевые остатки цепи А.
Биосинтез инсулинавключает образование двух неактивных предшественников, препроинсулина и проинсулина, которые в результате последовательного протеолиза превращаются в активный гормон. Биосинтез препроинсулина начинается с образования сигнального пептида на полирибосомах, связанных с ЭР. Сигналыный пептид проникает в просвет ЭР и направляет поступление в просвет ЭР растущей полипептидной цепи. После окончания синтеза препроинсулина сигнальный пептид, включающий 24 аминокислотных остатка, отщепляется (рис. 11-24).
Проинсулин (86 аминокислотных остатков) поступает в аппарат Гольджи, где под действием специфических протеаз расщепляется в нескольких участках с образованием инсулина (51 аминокислотный остаток) и С-пептида, состоящего из 31 аминокислотного остатка.
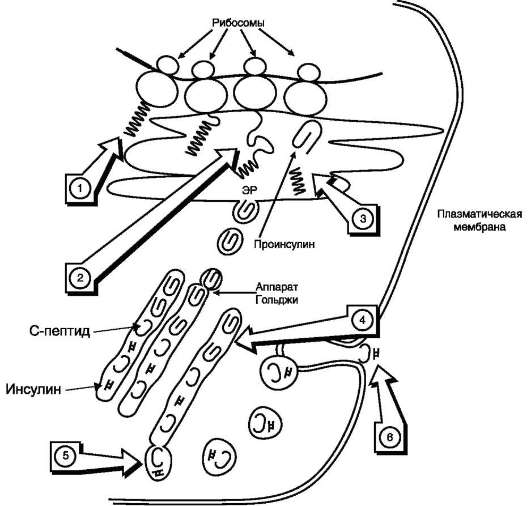
Рис. 11-24. Схема биосинтеза инсулина вβ-клетках островков Лангерханса.ЭР - эндоплазматический ретикулум. 1 - образование сигнального пептида; 2 - синтез препроинсулина; 3 - отщепление сигнального пептида; 4 - транспорт проинсулина в аппарат Гольджи; 5 - превращение проинсулина в инсулин и С-пептид и включение инсулина и С-пептида в секреторные гранулы; 6 - секреция инсулина и С-пептида.
Инсулин и С-пептид в эквимолярных количествах включаются в секреторные гранулы. В гранулах инсулин соединяется с цинком, образуя димеры и гексамеры. Зрелые гранулы сливаются с плазматической мембраной, и инсулин и С-пептид секретируются во внеклеточную жидкость в результате экзоцитоза. После секреции в кровь олигомеры инсулина распадаются. T1/2 инсулина в плазме крови составляет 3-10 мин, С-пептида - около 30 мин.
Разрушение инсулина происходит под действием фермента инсулиназы в основном в печени и в меньшей степени в почках.
Регуляция синтеза и секреции инсулина.Глюкоза - главный регулятор секреции инсулина, а β-клетки - наиболее важные глюкозо-чувстви-тельные клетки в организме. Глюкоза регулирует экспрессию гена инсулина, а также генов других белков, участвующих в обмене основных энергоносителей. Действие глюкозы на скорость экспрессии генов может быть прямым, когда глюкоза непосредственно взаимодействует с транскрипционными факторами, или вторичным, через влияние на секрецию инсулина и глюкагона. При стимуляции глюкозой инсулин быстро освобождается из секреторных гранул, что сопровождается активацией транскрипции мРНК инсулина.
Синтез и секреция инсулина не являются строго сопряжёнными процессами. Синтез гормона стимулируется глюкозой, а секреция его является Са2+-зависимым процессом и при дефиците Са2+ снижается даже в условиях высокой концентрации глюкозы, которая стимулирует синтез инсулина.
Потребление глюкозы β-клетками происходит в основном при участии ГЛЮТ-1 и ГЛЮТ-2, и концентрация глюкозы в клетках быстро уравнивается с концентрацией глюкозы в крови. В β-клетках глюкоза превращается в глюкозо-6-фосфат глюкокиназой, имеющей высокую Кт, вследствие чего скорость её фосфорилирования почти линейно зависит от концентрации глюкозы в крови. Фермент глюкокиназа - один из важнейших компонентов глюкозо-чувстви-тельного аппарата β-клеток, в который, помимо глюкозы, вероятно, входят промежуточные продукты метаболизма глюкозы, цитратного цикла и, возможно, АТФ. Мутации глюкокиназы приводят к развитию одной из форм сахарного диабета.
На секрецию инсулина влияют другие гормоны. Адреналин через α2-рецепторы тормозит секрецию инсулина даже на фоне стимуляции глюкозой, β-адренергические агонисты её стимулируют, вероятно, в результате повышения концентрации цАМФ. Этот механизм, полагают, лежит в основе действия гормонов ЖКТ, таких как секретин, холецистокинин и желудочный ингибирующий пептид (GIP), которые повышают секрецию инсулина. Высокие концентрации гормона роста, кортизола, эстрогенов также стимулируют секрецию инсулина.
Дата добавления: 2017-01-08; просмотров: 4151;











