Активация инсулином сигнального пути Ras.
Белок, известный как Ras-белок, относят к семейству малых ГТФ-связывающих белков. В неактивном состоянии Ras-белок прикреплён к внутренней поверхности плазматической мембраны и связан с ГДФ. Стимуляция инсулином приводит к образованию активной ГТФ-связан-ной формы Ras (рис. 11-25).
Превращение Ras-белка в активную форму происходит при участии семейства белков, являющихся активаторами протеинкиназ и протеинкиназами и, так же, как Ras-белок, получившие свои названия от онкогенов (см. раздел 16). Один из субстратов инсулинового рецептора Shc участвует в образовании комплекса с небольшим цитозольным белком Grb. Образовавшийся комплекс взаимодействует с Ras-белком. В этот комплекс включаются другие белки: GAP (от англ. GTP-ase activating factor - фактор, активирующий ГТФ:азу), GEF (от англ. GTP exchange factor - фактор обмена ГТФ) и SOS (от англ. son of sevenless, названный по мутации гена у мушки дрозофилы). Два последних белка способствуют отделению ГДФ от Ras-белка и присоединению ГТФ. Активированный Ras соединяется с протеинкиназой Raf-1. Raf-1 в неактивном состоянии находится в цитозоле в соединении с шаперонами. Активация Raf-1 происходит в результате многоэтапного процесса, включающего присоединение белка к плазматической мембране, фосфорилирование и взаимодействие с рецептором инсулина. Активированная Raf-киназа стимулирует каскад реакций фосфорилирования и активации других протеинкиназ, в частности, митогенактиви-руемых протеинкиназ (МАПК). При участии Raf-1 сначала фосфорилируется и активируется киназа МАПК, которая, в свою очередь, фос-форилирует МАПК.
МАПК фосфорилирует многие цитоплаз-матические белки: протеинкиназу рр90S6, белки рибосом, фосфолипазу А2, активаторы транскрипции (ПСАТ). Путь Ras активируется не только инсулином, но и многими другими гормонами и факторами роста. Многие компоненты этого пути являются продуктами протоонкогенов, мутации которых приводят к
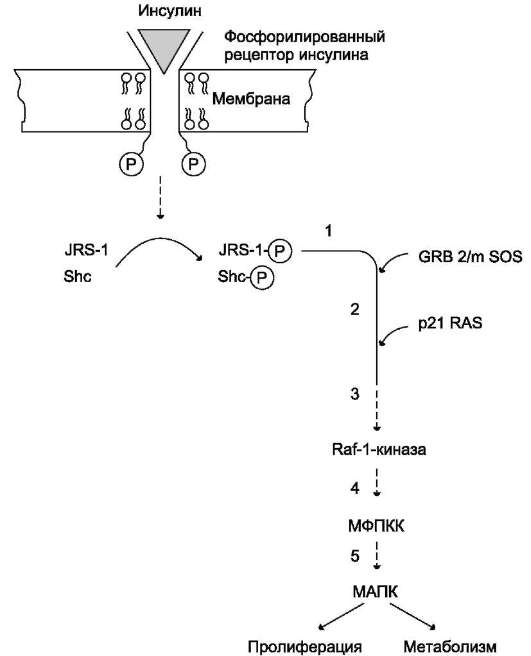
Рис. 11-25. Активация Ras-пути инсулином.1 - GRB-2/mSOS - цитозольный белок нековалентно присоединяется к фосфорилированному рецептору инсулина при участии одного из субстратов инсулинововго рецептора - Shc; 2 - образовавшийся комплекс взаимодействует с белком Ras; в этот комплекс включаются также белки, которые обеспечивают отделение от Ras ГДФ и присоединение ГТФ; 3 - активированный Ras соединяется с протеинкиназой Raf-1, вследствие чего происходит активация Raf-1-киназы; 4, 5 - активированная Raf-1-киназа стимулирует каскад реакций фосфорилирования и активации других протеинкиназ, в частности, МАПКК и МАПК. МАПК фосфорилируют многие цитоплазматические белки и факторы транскрипции. МАПК - митогенактивируемые протеинкиназы.
злокачественной трансформации клеток (см. раздел 16).
Эффекты инсулинамогут проявляться в течение секунд и минут (транспорт веществ, фосфо-рилирование и дефосфорилирование белков, активация и ингибирование ферментов, синтез РНК) или через несколько часов (синтез ДНК, белков, рост клеток).
Активация фосфоинозитол-3-киназы(ФИ-3-кина-зы). Этот фермент катализирует фосфорилирова-
ние ФИ, ФИ-4-фосфата и ФИ-4,5-бисфосфата в положении 3, образуя полифосфоинозитиды: ФИ-3-фосфат, ФИ-3,4-бисфосфат, ФИ-3,4,5-трифос-фат, которые в разных клетках стимулируют мобилизацию Са2+ и активацию специфических протеинкиназ (см. раздел 5). Активация ФИ-3-киназы стимулирует транслокацию ГЛЮТ-4 в плазматическую мембрану и таким образом ускоряет трансмембранный перенос глюкозы в клетки жировой и мышечной ткани. В жиро-
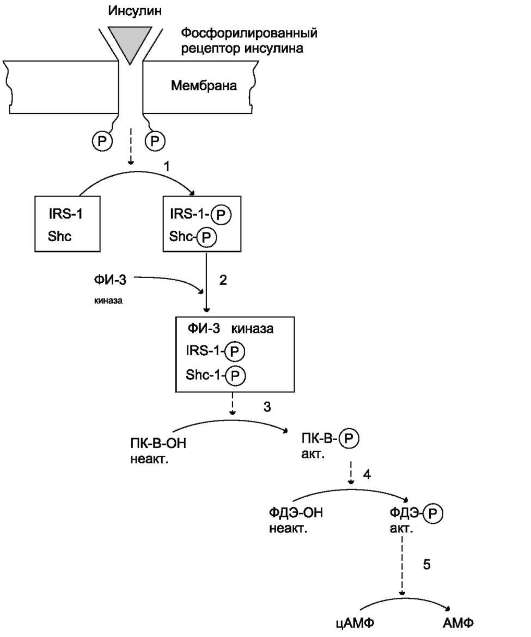
Рис. 11-26. Активация фосфодиэстеразы адипоцитов инсулином.1 - фосфорилированный рецептор инсулина фосфорилирует субстраты инсулинового рецептора; 2 - образование комплекса фосфоинозитол-3-киназы (ФИ-3-киназы) с активированными субстратами инсулинового рецептора; 3 - активация протеинкиназы В (ПК-В); 4 - протеинкиназа В активирует фосфодиэстеразу (ФДЭ) путём фосфорилирования; 5 - ФДЭ катализирует реакцию превращения цАМФ в АМФ.
вой ткани активация ФИ-3-киназы приводит к торможению липолиза. Снижение скорости липолиза происходит в результате активации фосфодиэстеразы и уменьшения внутриклеточной концентрации цАМФ (рис. 11-26).
Активация гликогенсинтазы инсулином.Одной из протеинкиназ, активируемых через путь Ras, является протеинкиназа pp90S6. Этот фермент фосфорилирует протеинфосфатазу, связанную с
гранулами гликогена. При фосфорилировании протеинфосфатаза активируется и дефосфори-лирует киназу гликогенфосфорилазы, глико-генфосфорилазу и гликогенсинтазу. Дефосфо-рилированные формы киназыфосфорилазы и гликогенфосфорилазы неактивны, вследствие чего мобилизация гликогена замедляется. Гли-когенсинтаза, напротив, активируется, и синтез гликогена ускоряется (рис. 11-27).
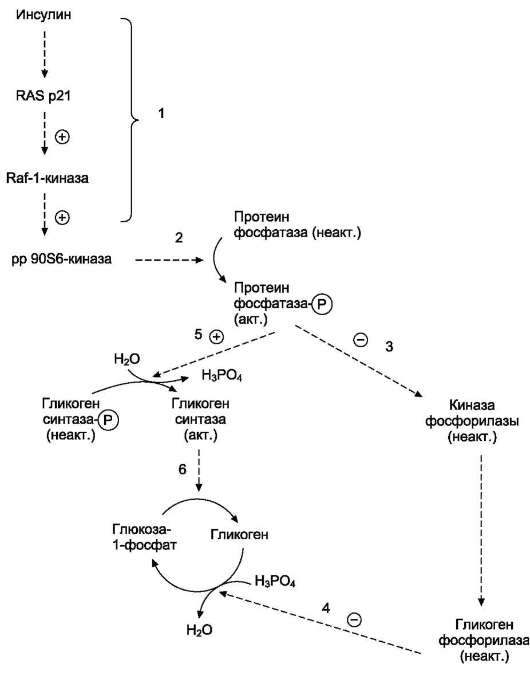
Рис. 11-27. Активация гликогенсинтазы инсулином.1 - активация пути RAS; 2 - протеинкиназа рр90S6, активируемая инсулином через путь RAS (рис. 11-25), фосфорилирует протеинфосфатазу гранул гликогена, которая включает каскад реакций дефосфорилирования; 3 - инактивация киназыфосфорилазы и гликоген-фосфорилазы; 4 - торможение мобилизации гликогена; 5 - активация гликогенсинтазы; 6 - стимуляция синтеза гликогена.
Инсулин влияет на скорость транскрипции более, чем 100 специфических мРНК в печени, жировой ткани, скелетных мышцах и сердце. Впервые влияние инсулина на транскрипцию генов было показано на примере фосфоенол-пируваткарбоксикиназы - ключевого фермента глюконеогенеза, скорость синтеза которого в культуре клеток гепатомы снижалась в течение нескольких минут.
Глюкагон
Глюкагон - одноцепочечный полипептид, состоящий из 29 аминокислотных остатков. Биосинтез глюкагона происходит в α-клетках островков Лангерханса, в нейроэндокринных клетках кишечника и в некоторых отделах ЦНС. Неактивный предшественник проглюкагон в результате частичного протеолиза превращается в несколько пептидов. В клетках поджелудочной
железы главный пептид - глюкагон; в клетках кишечника образуются глюкагоноподобные пептиды (от англ. GLP - glucagon like peptide): GLP-1, GLP-2, глицентин и другие. GLP-1 ингибирует секрецию глюкагона и стимулирует синтез и секрецию инсулина. Стимулятором секреции GLP-1 служит другой гормон - желудочный ингибирующий полипептид (от англ. GIP - gastrial inhibitor peptide), который синтезируется в клетках слизистой оболочки верхних отделов тонкого кишечника. Секреция GIP стимулируется при приёме пищи; наиболее сильным стимулятором служит глюкоза. На секрецию глюкагона влияют и многие другие соединения, включая аминокислоты, жирные кислоты, кетоновые тела и нейромедиаторы. При приёме пищи, богатой углеводами, секреция глюкагона снижается. Белковая пища стимулирует секрецию инсулина и глюкагона; однако некоторые аминокислоты в большей степени влияют на секрецию одного из них. Например, аланин стимулирует секрецию глю-кагона, но не инсулина.
В плазме крови глюкагон не связан с каким-либо транспортным белком. T1/2 гормона составляет ~5 мин. В печени глюкагон быстро разрушается под действием специфических протеаз.
Эффекты глюкагонав основном противоположны эффектам инсулина. Основные клетки-мишени глюкагона - печень и жировая ткань. Связываясь с рецепторами на плазматической мембране клеток-мишеней, глюкагон повышает содержание цАМФ (см. раздел 5). В гепатоци-тах это приводит к активации фосфорилазы гликогена и к снижению активности гликоген-синтазы. В результате ускоряется мобилизация гликогена. Фосфорилирование пируваткиназы и БИФ вызывает торможение гликолиза и ускорение глюконеогенеза. Кроме того, глюкагон стимулирует глюконеогенез, индуцируя синтез ферментов: глюкозо-6-фосфатазы, фосфоенол-пируваткарбоксикиназы, фруктозо-1,6-бис-фосфатазы (см. раздел 7). В клетках жировой ткани глюкагон через аденилатциклазный каскад активирует гормончувствительную ТАГ-липазу и стимулирует липолиз (см. раздел 8). Таким образом, в противоположность инсулину глюкагон стимулирует мобилизацию основных энергоносителей - углеводов и жиров.
Дата добавления: 2017-01-08; просмотров: 5215;











