Химические свойства металлов.
К химическим свойствам следует отнести способность металлов сопротивляться окислению или вступать в соединения с различными веществами: кислородом воздуха, влагой (металлы, соединяясь с кислородом и водой, образуют основания (щелочи)), углекислотой, и д.р.Чем лучше металл вступает в соединения с другими элементами, тем легче он разрушается. Химическое разрушение металлов под действием окружающей среды при обыкновенной температуре называется коррозией металлов.
К химическим свойствам металлов относится способность образовывать окалину при нагреве в окислительной атмосфере, а также растворяться в различных химически активных жидкостях: кислотах, щелочах и т.п. Металлы, стойкие к окислению при сильном нагреве, называются жаростойкими (окалиностойкими).
Способность металлов сохранять в условиях высоких температур свою структуру, не размягчаться и не деформироваться под воздействием нагрузки называется жароупорностью.
Сопротивление металлов коррозии, окалинообразованию и растворению определяется по изменению веса испытуемых образцов на единицу поверхности за единицу времени.
Коррозия металлов. Словом «коррозия» (по-латыни – «разъедание») принято обозначать широко известные явления, заключающиеся в ржавлении железа, покрытие меди зеленым слоем окиси и тому подобных изменениях металлов.
В результате коррозии металлы частично или полностью разрушаются, качество изделий ухудшается, и они могут оказаться непригодными для использования.
Большинство металлов встречается в природе в виде соединений с другими элементами, например, железо – в виде Fe2O3, Fe3O4, FeCO3, медь – в виде CuFeS2, Cu2S, алюминий – в виде Al2O3, и т.д. В результате металлургических процессов устойчивая связь металлов с веществами, имевшаяся в природном состоянии, нарушается, но она восстанавливается в условиях соединения металлов с кислородом и другими элементами. В этом заключается причина возникновения коррозии.
Разработка теории коррозии является заслугой русских ученых В.А.Кистяковского, Г.В.Акимова, Н.А.Изгарышева и д.р. по мнению исследователей явлений коррозии, существуют два вида коррозии: электрохимическая и химическая коррозия.
Электрохимической коррозией (Рис.13.) называется процесс разрушения металлов при соприкосновении с жидкостями, проводящими электрический ток (электролитами), т.е. с кислотами, щелочами, растворами солей в воде, водой с растворенным в ней воздухом. Происходящие здесь явления подобны тем, которые можно наблюдать в гальваническом элементе. В стали, например, гальванический элемент образует карбид железа и феррит. В электролитах карбид остается неизменным, феррит же растворяется и дает с веществом электролита ржавчину – продукт коррозии.
О поведении различных металлов в электролитах можно судить по занимаемому ими месту в ряду напряжений: калий, кальций, магний, алюминий, марганец, цинк, хром, железо, кадмий, кобальт, никель, олово, свинец, водород, сурьма, висмут, медь, ртуть, серебро, золото. В приведенном ряду металлы расположены по величине нормального электрического потенциала (т.е. полученного при погружении металла в нормальный раствор его соли) по отношению к водороду. Каждый металл этого ряда в паре с другим в электролитах образует гальванический элемент, причем разрушаться будет тот металл, который в ряду располагается левее. Так, в паре медь – цинке разрушается цинк. Ряд напряжений имеет весьма большое практическое значение: он указывает на опасность располагать в непосредственном соприкосновении разнородные металлы, так как этим создаются условия для образования гальванического элемента и разрушения одного из металлов, левее располагающегося в ряду напряжений.
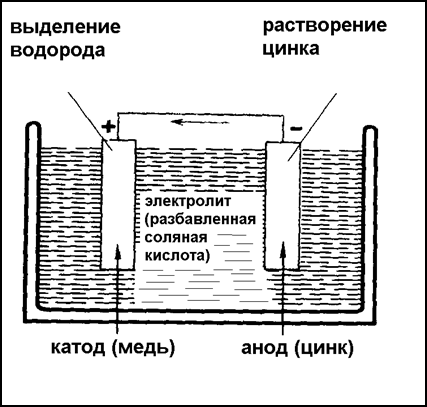
Рис.13.Схема, иллюстрирующая процесс электрохимической коррозии. На одном полюсе растворяется (корродирует) неблагородный металл, на другом – выделяется водород.
Химической коррозией называется разрушение металлов и сплавов в сухих газах при высокой температуре и в жидкостях, не имеющих свойств электролитов, например, в масле, бензине, расплавленных солях и д.р. При химической коррозии под действием кислорода воздуха металлы покрываются тончайшим слоем окислов. При химической коррозии металл подвергается не всегда только поверхностному разрушению, но коррозия проникает и в глубину металла, образуя очаги или располагаясь по границам зерен. (пример. Серебряные предметы со временем темнеют, потому что в воздухе содержаться газообразные соединения серы, которые вступают в химическую реакцию с серебром. Образующийся при этом сульфид серебра остается на поверхности изделий в виде коричневатой или черной пленки.)
Дата добавления: 2016-12-27; просмотров: 3390;











