ПОНЯТИЕ ОБ ЭЛЕКТРОННОЙ ТЕОРИИ СТРОЕНИЯ ВЕЩЕСТВА 5 глава
· Электрическая сварка, осуществляется как на постоянном, так и на переменном токе.
· Каждое прикосновение угольного или металлического стержня к свариваемому предмету для источника электрической энергии ведет К короткому замыканию. Поэтому для питания сварочных установок применяют специальные источники электрической энергии (генераторы, трансформаторы), которые переносят короткие замыкания, не выходя из строя.
· Тепловое действие электрической дуги используют также в электромартенах или дуговых печах, предназначенных для выплавки стали и цветных металлов. Дуговая печь сложена из огнеупорного кирпича и защищена снаружи стальным кожухом. Верхнюю ее часть (свод) снимают и через нее в рабочее пространство печи пропускают угольные или графитовые электроды. Температура между электродами в печи достигает 6000—8000°.
· Дуговая печь позволяет очень просто регулировать температуру изменением величины тока. Она экономична, так как исключает потери энергии, неизбежные при передаче тепла металлу от топлива, сгорающего в обособленном помещении.
· Такие специальные стали, как инструментальная, нержавеющая, жаростойкая и жаропрочная, выплавляют в настоящее время только в электрических печах.
·
·
· § 27. ХИМИЧЕСКОЕ ДЕЙСТВИЕ ЭЛЕКТРИЧЕСКОГО ТОКА
·
· Растворы солей и кислот в воде или в каком-либо другом растворителе проводят электрический ток и называются электролитами или проводниками второго рода в отличие от металлических проводников, называемых проводниками первого рода.
· Электрический ток может проходить через среды, имеющие электрически заряженные частицы, обладающие способностью перемещаться.
· При растворении солей и кислот в воде или в каком-либо ином растворителе (этиловый спирт, бензин, бензол и др.) часть молекул распадается на две части, называемые ионами, причем одна часть имеет положительный заряд, другая — отрицательный заряд.
· Таким образом, в отличие от металлических проводников, где переносчиками электричества являются электроны, в электролитам ими служат ионы. Ионы могут быть простыми и сложными. Простой ион образован одним атомом вещества. Ионы, состоящие из нескольких атомов, называются сложными.
· Распад химических соединений на ионы под действием растворителя называется электролитической диссоциацией и выражается обычными химическими уравнениями, в левой части которых помещаются химические символы распадающихся веществ, а в правой — образующиеся из этих веществ ионы. Например, уравнение диссоциации поваренной соли (хлористого натрия) записывается следующим образом:
· 
· Для более сложных соединений процесс диссоциации может протекать в несколько стадий.
· Если в сосуд с электролитом погружены две металлические пластины, называемые электродами, которые при помощи проволочных проводников присоединены к источнику энергии постоянного тока, то вследствие разности потенциалов между электродами, через электролит будет протекать ток. Прохождение тока через электролит сопровождается химическим процессом, называемым электролизом. Находящиеся в электролите ионы, притягиваясь к электродам, двигаются в противоположных направлениях: положительные ионы — к катоду, а отрицательные ионы — к аноду. Подойдя к катоду, положительные ионы получают от него недостающие им электроны и образуют электрически нейтральные атомы. На аноде происходит обратный процесс: отрицательные ионы отдают аноду свои избыточные электроны. Например, при электролизе раствора поваренной соли на катоде отлагаются положительные ионы натрия, а на аноде — отрицательные ионы хлора.
· В результате непрерывного перехода электронов с катода на ионы и поступления их на анод поддерживается движение электронов в проводах, соединяющих источник электрической энергии с электродами.
· При прохождении электрического тока через электролит на электродах выделяются определенные количества веществ, содержащихся в виде химического соединения в электролите. Зависимость выделенного вещества от силы тока устанавливается двумя законами Фарадея.
· Первый закон Фарадея сформулирован так: количество вещества, выделившегося на электродах при прохождении тока через электролит, прямо пропорционально количеству электричества, прошедшему через электролит. При прохождении одного кулона электричества из электролита выделяется определенное весовое количество вещества, которое называется электрохимическим эквивалентом данного вещества.
· В практических расчетах для определения количества электричества удобнее пользоваться не кулонами, а ампер-часами (ач). Так как один кулон равен ампер-секунде, то между ампер-часом и рулоном имеет место следующее соотношение:
· 1 ач = 60х60 = 3600 асек = 3600 к.
· Электрохимический эквивалент выражается в граммах, отнесенных к одному ампер-часу количества электричества (г/а-ч), т. е. это весовое количество вещества, выделившегося из электролита и выраженное в граммах, при прохождении через электролит одного ампер-часа количества электричества.
· Обозначив через I неизменную силу тока, протекающего через электролит в течение t (ч), а электрохимический эквивалент данного вещества через К, определим весовое количество данного вещества q (r), выделившегося за это время:
· 
· Например, если при прохождении через меднокислый электролит тока в 1 а в течение одного часа на катоде выделяется 1,186 г меди, то при силе тока в 10 а из такого же раствора за 10 ч выделится
· 1,1861010= 118,6 г.
· Второй закон Фарадея гласит: при одном и том же количестве электричества, протекающего через различные электролиты, весовые количества веществ, выделившихся на электродах, пропорциональны их химическим эквивалентам.
· Из курса химии известно, что одновалентный элемент имеет атомный вес, равный химическому эквиваленту, а n-валентный элемент обладает химическим эквивалентом, в n раз меньшим атомного веса, т. е.
· 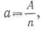
· где A-атомный вес, n- валентность, а-химический эквивалент
· Например, атомный вес алюминия А=27, валентность n = 3, следовательно, его химический эквивалент
· 
· Из сопоставления 1-го и 2-го законов Фарадея вытекает, что электрохимические эквиваленты пропорциональны их химическим эквивалентам, т. е.
·
· 
· Следовательно, отношение электрохимических эквивалентов к их химическим эквивалентам является величиной постоянной и равно
· 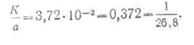
·
· Итак, второй закон Фарадея может быть выражен следующим образом:
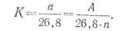
|
·
·
· Пример. Из электролита в течение 10 ч выделилось 50 г цинка. Определить ток, протекающий через электролит. Электрохимический эквивалент цинка К= 1,22 г/а ч.
· Решение, Согласно первому закону Фарадея имеем:
· 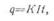
·
· откуда
·
· 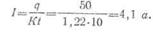
· Электролиз получил широкое применение в различных отраслях промышленности. Впервые он был использован для гальванопластики, представляющей собой получение копий с рельефов. С этой целью гипсовый оттиск (негатив) со снимаемого рельефа покрывают слоем графита и погружают в раствор соли металла, который осаждается на оттиске, как на катоде. После удаления гипса получается металлическая копия рельефа.
· С помощью электролиза наносят относительно тонкие покрытия одних металлов на другие (гальваностегия). Гальваностегия используется для придания изделиям декоративного вида и для защиты от коррозии. Таким способом производят золочение, серебрение, никелирование и т. д.
· Электролиз служит также для очистки (рафинирования) металлов, например меди. Пластины литой меди, полученной путем обжига руды, опускают в качестве анодов в ванны, содержащие раствор медного купороса, подкисленный серной кислотой для повышения проводимости электролита. Катодами в этих ваннах являются тонкие медные кисти, на которых отлагается электролитическая медь, а примеси осаждаются на дно ванны.
· Весьма распространен электролитический способ получения едких щелочей натрия, калия и хлора, а также кислорода и водорода путем разложения воды, подкисленной серной кислотой.
· Явление электролиза представляет опасность для ряда подземных сооружений. Под действием электролиза блуждающими токами могут быть разрушены броня кабелей, водопроводных и газовых труб и других металлических сооружений. Главнейшим источником этих токов является электрооборудование транспорта — трамваев и электрифицированных железных дорог. Особенно вредно действуют блуждающие, токи на подземные телефонные кабели, покровом которых является голая свинцовая оболочка.
·
·
· § 28. ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ
·
· Проводники первого рода (твердые) и второго рода (жидкие электролиты) совместно используются в
· гальванических элементах, служащих источниками постоянного тока.
· В гальванических элементах во время их работы происходит движение ионов и оседание на электродах элемента, выделяющегося из электролита вещества.
· Простейшим гальваническим элементом является медно-цинко-вый. В стеклянный сосуд,, наполненный раствором серной кислоты H2SO4 в воде Н20, погружены медная Cu и цинковая Zn пластины, которые представляют собой положительный и отрицательный полюсы элемента.
· При замыкании цепи элемента каким-либо проводником внутри этого элемента будет протекать ток от цинковой отрицательной пластины к медной положительной, а во внешней цепи — от медной к цинковой. Под действием тока внутри элемента положительные ионы водорода Н2 движутся по направлению тока, отрицательные ионы кислотного остатка SO4 — в противоположном направлении. Приходя в соприкосновение с медной пластиной, положительные ионы водорода отдают ей свои заряды, а водород в виде пузырьков газа скопляется на ее поверхности. В это же время отрицательные ионы остатка серной кислоты отдают свои заряды цинковой пластине. Таким образом происходит непрерывный заряд пластин элемента, поддерживающий разность потенциалов (напряжение) на его зажимах.
· Выделение водорода на медной пластине элемента ослабляет его действие, поляризует элемент. Явление поляризации состоит в том, что скопляющийся на положительном электроде водород создает в совокупности с металлом электрода дополнительную разность потенциалов, называемую электродвижущей силой поляризации. Эта э. д. с. направлена противоположно электродвижущей силе элемента. Кроме того, пузырьки водорода, покрывающие часть медной пластины, уменьшают ее действующую поверхность, а это увеличивает внутреннее сопротивление элемента.
· Поляризация в рассмотренном элементе настолько значительна, что делает его непригодным для практических целей. Устранение явления поляризации в современных элементах осуществляется посредством поглотителей, вводимых в состав элемента и носящих название деполяризаторов, которые предназначены для поглощения водорода и не допускают скопления его на положительном полюсе элемента. Такими деполяризаторами могут служить химические препараты, богатые кислородом или хлором.
· Э. д. с. гальванического элемента зависит от химических и физических свойств веществ, его составляющих и, как показывает опыт, не зависит ни от формы и размеров элемента, ни от его внутреннего устройства. Но внутреннее устройство и размеры отдельных частей элемента имеют большое влияние на величину его внутреннего сопротивления, так как они зависят от расстояния между полюсами (при уменьшении этого расстояния внутреннее сопротивление элемента уменьшается), от размера погруженной в жидкость поверхности полюсов (при увеличении этой поверхности внутреннее сопротивление уменьшается), от химического состава жидкости элемента. Необходимо отметить, что внутреннее сопротивление гальванических элементов не является величиной постоянной (по мере работы элемента оно постепенно возрастает).
· В зависимости от способа деполяризации гальванические элементы могут быть подразделены на два типа: элементы, в которых в качестве деполяризатора применяют раствор какой-либо соли, например медно-цинковые, и элементы, в которых анод окружен перекисью марганца, например, угольно-цинковые. Гальванические элементы указанных двух типов широко применяют в электротехнике.
· 
· Э. д. с. медно-цинкового элемента равна 1,1 в, а внутреннее сопротивление в зависимости от времени работы — 5 - 10 ом.
· В угольно-цинковом элементе положительным полюсом служит угольная пластина, а отрицательным — цинковый стержень. Деполяризатором в этом элементе является спрессованная под большим давлением смесь, называемая агломератом. Она состоит из перекиси марганца и графита. В качестве электролита в угольно-цинковом элементе применяют водный раствор хлористого аммония NН4Cl. Электродвижущая сила угольно-цинкового элемента 1,4—1,5 в в начале разряда при среднем значении 0,9 - 1,1 в, а внутреннее сопротивление в зависимости от конструкции элемента— 0,25 -0,7 ом в начале разряда и 1,4—5 ом в конце.
· Угольно-цинковые элементы выпускает отечественная промышленность в виде так называемых сухих элементов стаканчикового и галетного типов, весьма удобных для переноски и перевозки.
· В сухих элементах стаканчикового типа (рис. 24) положительный полюс 8 с агломератом 2 помещают внутри цинковой коробки 9, которая служит отрицательным полюсом элемента. Пространство между стенками цинковой коробки и агломератом заполняют, пастой 1, состоящей из раствора хлористого аммония и картофельной муки. Над агломератом укладывают картонную прокладку 3,1 на которую насыпают прослойку 4 из опилок; сверху опилки закрывают картонной прокладкой 5. Затем элемент заливают смолой 7, в которую вставляют трубку 6. Назначение этой трубки — удалять образующиеся внутри элемента газы.
· На выходящий из смолы угольный электрод насаживают медный колпачок с винтом и гайкой для присоединения проводника. К верхней части цинковой коробки (отрицательному полюсу) припаивают изолированный гибкий проводник. На дно коробки укладывают изолирующую прокладку 10.
· В галетном элементе отрицательным электродом является цинковая пластина, положительным — спрессованный в виде галеты порошок двуокиси марганца с углем. Между электродами помещают картонную пластинку, пропитанную раствором нашатырного спирта. Наружная поверхность цинковой пластины покрыта слоем канифоли с частицами графита для электропроводности.
· В качестве изоляции используются хлорвиниловые пленки. Галетные элементы компактны и их активные материалы (особенно цинк) используются лучше, чем в стаканчиковых элементах.
· В окисно-ртутных элементах отрицательным электродом является цинк, а положительным — окись ртути. Их преимущество по сравнению с угольно-цинковыми элементами состоит в хорошей сохранности при повышенной температуре, меньшем изменении напряжения при разряде и большой удельной энергии на единицу объема, что особенно ценно для использования в переносной аппаратуре в условиях теплого климата.
· В настоящее время широко применяют элементы ВДЛ, электродами которых служит цинк и активированный пористый уголь, адсорбирующий кислород из воздуха, а электролитом — раствор едкого калия. Достоинство этих элементов - малое изменение напряжения при разряде. Вследствие герметичности элементов ВДЛ не происходит заметного ухудшения свойств едкого калия, поэтому они могут храниться неограниченное время. После полного разряда элемента угольный электрод сохраняет работоспособность и элемент может быть восстановлен путем замены цинка и электролита. Такое восстановление элемента можно производить дважды. Э. д. с. элемента ВДЛ 1,4 в, напряжение при нормальном режиме разряда 1,2—1,25 в, напряжение в конце разряда 0,9 в.
· Ввиду дефицитности и высокой стоимости цинка желательно использовать в качестве отрицательного электрода какой-либо другой металл, например железо.
· В последние годы разработаны железо-угольные щелочные элементы ВДЖ, применяемые для питания радиоустройств в труднодоступных для обслуживания местностях. Однако замена цинка железом привела к уменьшению э. д. с. элемента. Начальное напряжение элемента ВДЖ 0,75 в, напряжение в конце разряда 0,45 в. Элементы ВДЖ выдерживают длительное хранение и нормально работают при температуре 0° С,
· Для составления батарей гальванические элементы соединяют между собой последовательно, параллельно и смешанно. При последовательном соединении положительный полюс первого элемента соединяется с отрицательным полюсом второго элемента, положительный полюс второго — с отрицательным третьего и т. д.
· Если батарея состоит из n последовательно соединенных элементов с э. д. с. каждого элемента Е0 и с внутренним сопротивлением r0 ом, то э. д. с. батареи Е=nЕ0, а внутреннее сопротивление ее r = nr0
· При параллельном соединении элементов положительные полюсы всех элементов соединяют между собой и отрицательные полюсы также соединяют между собой. В результате получают два общих полюса батареи: положительный и отрицательный. Если батарея состоит из m параллельно соединенных элементов с э. д. с. Каждого элемента E0 в и с внутренним сопротивлением r0 ом, то
· э. д. с. батареи Е = Е0, а внутреннее сопротивление ее 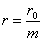
· Для составления батареи из смешанно соединенных элементов разделяют все элементы на группы с одинаковым числом их в каждой группе. Элементы в каждой группе соединяют параллельно или последовательно, а группы между собой в первом случае — последовательно, а во втором — параллельно.
· Если n — число групп или элементов в группе, соединенных поcледовательно, m — число групп или элементов в группе, соединении параллельно, Е0 — э. д. с. каждого элемента, а r0 —внутреннее сопротивление, то э. д. с. батареи Е = nЕ0, а ее внутреннее сопротивление 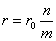 .
.
·
· Пример 1. Четыре гальванических элемента, у которых э. д. с. каждого Е0 = 1,6 в и внутреннее сопротивление r0=8 ом, соединены параллельно. Определить силу тока в цепи, если батарея замкнута на внешнее сопротивление 6 ом.
· Решение. Э. д. с. батареи E=1,6 в, внутреннее сопротивление ее 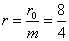 =2 ом. 4
=2 ом. 4
· Следовательно, сила тока в цепи .
· 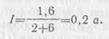
· .Пример 2. Последовательно соединены 10 гальванических элементов, каждый из которых имеет э. д. с. 1,2 в и внутреннее сопротивление 5 ом. Определить силу тока в цепи, если батарея замкнута на внешнее сопротивление 30 ом.
· Решение. Э. д. с. батареи E=10x1,2= 12 в. Внутреннее сопротивление батареи r== 10x5=50 ом. Следовательно, сила тока цепи 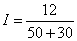 =0,15 а.
=0,15 а.
·
·
· § 29. АККУМУЛЯТОРЫ
·
· Аккумулятором называется прибор, обладающий способностью накапливать и сохранять в течение некоторого времени электрическую энергию в результате химических процессов.
· В аккумуляторе, как и в гальваническом элементе, электрический ток является следствием химических процессов. Но в отличие от аккумулятора в гальваническом элементе получающиеся химические соединения не могут быть вторично разложены и приведены в первоначальное состояние током постороннего источника. Поэтому гальванические элементы называются первичными, а аккумуляторы — вторичными или обратимыми. Повторные заряд и разряд не 1 только не вредят аккумулятору, но даже улучшают его свойства, так как в работе участвуют все более глубокие слои пластин электродов.
· В зависимости от состава электролита аккумуляторы могут быть кислотными и щелочными. Простейший кислотный аккумулятор состоит из двух свинцовых пластин (электродов), погруженных в электролит, которым служит вода с небольшим добавлением серной кислоты.
·
· Постоянный ток постороннего источника, проходя через электролит, разлагает его на составные части. Внутри электролита возникает движение положительных ионов водорода Н2 к пластине, соединенной с отрицательным зажимом источника тока, и отрицательных ионов кислорода О к пластине, соединенной с положительным зажимом источника тока. В результате электролиза окисляется свинец на положительном электроде и образуется губчатый свинец на отрицательном электроде.
·  Таким образом электрическая энергия преобразовывается в химическую и аккумулятор становится заряженным.
Таким образом электрическая энергия преобразовывается в химическую и аккумулятор становится заряженным.
· Химическая энергия может сохраняться определенное время и при надобности легко переходит в электрическую.
· Если аккумулятор отключить от источника тока и замкнуть на какой-нибудь приемник энергии, то аккумулятор сам станет источником тока подобно гальваническому элементу, у которого электродами служат пластины, отличающиеся друг от друга по химическому составу
· Электролитом в кислотных аккумуляторах, как указывалось выше, служит раствор серной кислоты определенной плотности. Плотностью раствора или его удельным весом называется число, показывающее, во сколько раз вес этого раствора больше веса воды того же объема.
· Для наполнения стационарных аккумуляторов употребляют раствор серной кислоты плотностью 1,21 при 15° С. Для переносных аккумуляторов применяют раствор серной кислоты плотностью 1,26.
· Плотность электролита определяют ареометром. Он представляет собой стеклянную трубку, запаянную с обеих концов и имеющую внутри шкалу с делениями. В нижней расширенной части ареометра находится ртуть или дробь, в результате чего трубка плавает вертикально. Ареометр опускают в сосуд с электролитом. Чем больше плотность электролита, тем выше поднимается ареометр из жидкости. Деление ареометра, расположенное на уровне раствора, показывает плотность электролита.
· При составлении раствора для аккумуляторов серную кислоту тонкой струей наливают в воду. Нельзя вливать в серную кислоту воду, так как произойдет бурное разбрызгивание кислоты, которая может причинить ожоги. Вода для электролита должна быть дистиллированной.
· Внутреннее сопротивление аккумуляторов очень мало по сравнению с внутренним сопротивлением гальванических элементов. Это дает возможность считать напряжение на зажимах аккумуляторной батареи примерно равным ее э. д. с. Однако внутреннее сопротивление не является постоянной величиной. Оно определяется составом пластин, расстоянием между ними, плотностью и температурой электролита, степенью заряженности аккумулятора. Так, сопротивление разряженного аккумулятора примерно в полтора- два раза больше, чем заряженного.
· Э. д. с. аккумулятора зависит от плотности электролита и не зависит от его размеров и номинальной емкости. При плотностях электролита d в пределах 1,1—1,35 э. д. с. аккумулятора
· 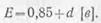
· В процессе заряда и разряда аккумулятора плотность электролита не остается постоянной, в связи с этим изменяется как его э. д. с, так и напряжение на его зажимах.
· При заряде кислотного аккумулятора напряжение его сравнительно быстро возрастает до 2,2 в (рис. 25, кривая 1), затем медленно достигает 2,3 в, после чего довольно быстро возрастает до 2,6 в и, наконец, медленно увеличивается до 2,7—2,75 в и выше не поднимается.
· По достижении напряжения 2,2 в у отрицательной пластины аккумулятора начинают выделяться пузырьки водорода, а при 2,3 в около положительной пластины появляются пузырьки кислорода.
При 2,5 в около обеих пластин происходит обильное выделение газов, а когда напряжение достигает 2,6—2,75 в аккумулятор, как говорят, начинает «кипеть». I
· При заряде аккумулятора увеличивается плотность электроли-1 та, вследствие чего напряжение на зажимах аккумулятора повышается. При напряжении 2,4—2,5 в аккумулятор полностью зарядится (заканчивается процесс восстановления активной массы). При дальнейшем процессе заряда происходит электролиз воды, при котором пластины аккумулятора покрываются пузырьками водорода и кислорода, что уменьшает активную поверхность пластин, увеличивая внутреннее сопротивление аккумулятора, вследствие чего увеличивается напряжение на его зажимах. Так как бурное выделение кислорода и водорода разрушает пластины, то в конце заряда следует уменьшить силу зарядного тока.
· При разряде кислотного аккумулятора напряжение на его зажимах быстро падает до 2—1,95 в (рис. 25, кривая 2), затем медленно понижается до 1,86—1,8 в и после этого снова быстро уменьшается до нуля.
· Понижение напряжения при разряде аккумулятора объясняется тем, что при разряде плотность его электролита уменьшается. Когда напряжение на аккумуляторе достигает значения 1,8 в (при кратковременном разряде 1,75 в), это значит, что вся запасенная в нем энергия израсходована (на обеих пластинах образуется сернокислый свинец, являющийся плохим проводником тока). При дальнейшем разряде напряжение быстро уменьшается до нуля. Если аккумулятор отключить от нагрузки, то его напряжение вновь увеличится примерно до 2 в, так как электролит проникает в глубь
· пластин в поры активной массы. Однако при включении такого аккумулятора вновь на нагрузку напряжение на его зажимах опять быстро уменьшится до нуля.
· Практически разряд доводят только до 1,8 в, так как при разряде ниже 1,8 в аккумулятор приходит в негодность — пластины его частично покрываются белым налетом крупнокристаллического сернокислого свинца, который представляет собой настолько плохой проводник, что заряд аккумулятора до номинальной емкости становится невозможным. Это явление называется сульфатацией пластин аккумулятора.
· Количество электричества, которое аккумулятор может отдать при разряде определенным током до наинизшего допустимого напряжения, называется его емкостью. Она равна произведению разрядного тока в амперах на продолжительность времени разряда в часах и выражается в ампер-часах.
· Емкость аккумулятора зависит от количества активной массы, величины тока и температуры. Под номинальной емкостью понимают то количество электричества, которое отдает полностью заряженный аккумулятор при 10-часовом режиме разряда и температуре 25° С. Таким образом, аккумулятор отдает номинальную емкость, разряжаясь в течение 10 ч током, численно равным 0,1 величины его номинальной емкости. При увеличении разрядного тока емкость аккумулятора уменьшается, так как поверхность пластин покрывается сернокислым свинцом и затрудняет доступ электролита к внутренним слоям активной массы. При понижении температуры увеличивается вязкость электролита, что также затрудняет его доступ к внутренним слоям активной массы и уменьшает емкость аккумулятора.
· В отключенном состоянии заряженный аккумулятор теряет часть запасенной им емкости. Это явление носит название саморазряда. Саморазряд аккумулятора увеличивается с повышением температуры и плотности электролита.
· Положительные пластины кислотных аккумуляторов изготовляют преимущественно поверхностными из свинца с глубокими бороздами для увеличения поверхности.
· Отрицательные пластины кислотных аккумуляторов выполняют коробчатыми. Они представляют собой решетку, в ее ячейках помещается активная масса (свинцовый глет); активную массу закрывают сеткой. Положительные пластины имеют темно-коричневый цвет, отрицательные — светло-серый.
· Для увеличения емкости аккумулятора несколько одноименных пластин соединяют параллельно (рис. 26). Каждая группа положительных и отрицательных пластин работает как одна большая пластина, площадь которой равна сумме площадей параллельно соединенных пластин. Так как положительные пластины должны находиться между отрицательными, число отрицательных пластин всегда на одну больше числа положительных. При этом условии обе стороны положительных пластин вступают во взаимодействие с электролитом (при односторонней работе положительные пластины коробятся и при соприкосновении с отрицательными пластинами может произойти короткое замыкание).
· Стационарные кислотные аккумуляторы изготовляют в стеклянных или керамических сосудах. Аккумуляторы больших емкостей имеют сосуды деревянные, выложенные внутри свинцом или
· кислотостойким изоляционным материалом. Кислотные аккумуляторы применяют на электротехнических установках стационарного типа и на автотранспорте. В качестве переносных аккумуляторов используют преимущественно щелочные аккумуляторы.
Дата добавления: 2021-04-21; просмотров: 506;











