ФУНКЦИОНАЛЬНЫЕ СВОЙСТВА БЕЛКОВ
Растительные белки находят применение в производстве пищевых продуктов в качестве ингредиентов питательной, технологической и лечебно-профилактической значимости благодаря присущим им уникальным функциональным свойствам. Понятие "функциональные свойства белков" впервые ввели Серкл и Джонсон в 1962 г. Под функциональными свойствами понимают физико-химические характеристики белков, определяющие их поведение при переработке в пищевые продукты и обеспечивающие определенную структуру, технологические и потребительские свойства (В. Толстогузов, 1987).
К наиболее важным функциональным свойствам белков относятся растворимость, водосвязывающая и жиросвязывающая способность, способность стабилизировать дисперсные системы (эмульсии, пены, суспензии), образовывать гели, пленкообразующая способность, адгезионные и реологические свойства (вязкость, эластичность), способность к прядению и текстурированию.
Белки с высокими функциональными свойствами хорошо растворяются в воде, образуют прочные гели, стабильные эмульсии и пены; белки с низкими функциональными свойствами не набухают в воде, не способны образовывать вязкие, эластичные массы, гели, не стабилизируют пены и эмульсии. Некоторые известные белки не попадают под указанные выше закономерности. Так, белки пшеничной клейковины, несмотря на низкую растворимость в воде (2–5%), образуют структурные коллоидные системы – гели, которые выдерживают нагревание, замораживание и сушку, а белки из отрубей и тритикале с растворимостью 10–20% обладают высокими жироэмульгирующими и пенообразующими свойствами. Отклонения от указанных выше закономерностей объясняются трудностью создания в экспериментах при оценке функциональных свойств стандартных условий, так как белки имеют разные оптимальные значения свойств, а модельные системы не учитывают многофункциональность и взаимодействие белков с другими компонентами пищи (липидами, углеводами и т. д.). Поэтому признано, что функциональные свойства белков должны выражаться не только в численных значениях, но и в профилях зависимостей от технологических или других факторов. Данный подход в оценке функциональных свойств нашел отражение в применении для белков нового термина – "технофункциональные", включающего особенности технологических процессов при производстве, хранении и потреблении пищевых продуктов. При этом функциональные свойства белков оцениваются для конкретных пищевых систем в рамках выбранного направления путем сравнения их со свойствами традиционных или других известных белков.
Растворимость, являясь первичным показателем оценки функциональных свойств белков, характеризуется коэффициентами КРА и КДБ. В первом случае определяют количество азота, во втором – количество белка, перешедшего в раствор (в процентах от общего содержания его в продукте). Специфическая последовательность аминокислотных остатков в полипептидных цепях, неравномерное расположение гидрофобных и гидрофильных групп на поверхности белков, наличие или отсутствие спирализованных участков обуславливают особенности функциональных свойств. Растворимость в наибольшей степени зависит от присутствия нековалентных взаимодействий: гидрофобных, электростатических и водородных связей (см. Строение пептидов и белков). При рассмотрении гидрофобных взаимодействий белков различают среднюю и относительную (поверхностную) гидрофобность. Под средней гидрофобностью понимают энергию стабилизации, приходящуюся на одну неполярную боковую группу при связывании ее внутри глобулы белковой молекулы, под относительной – степень гидрофобного взаимодействия неполярных остатков аминокислот, расположенных на поверхности глобул. Последний вид гидрофобности оценивается по связыванию с липидами и углеводами, распределению белков в двухфазных водных системах, содержащих полимеры с разной гидрофобностью, и т.д. За счет относительной гидрофобности осуществляется взаимодействие с липидами и формируется четвертичная структура белков. Чем ниже относительная гидрофобность белков (то есть ниже взаимодействие между глобулами и выше сила отталкивания), тем выше взаимодействие их с молекулами растворителя, следовательно выше растворимость.
Вклад электростатических сил в растворимость белков зависит от рН среды и присутствия солей. При рН, соответствующем ИЭТ, белки имеют наименьшую растворимость, так как суммарный заряд на их молекулах равен нулю и частицы лишены способности отталкиваться за счет электростатических взаимодействий с молекулами растворителя. В кислой или щелочной среде, наоборот, обеспечивается взаимодействие противоположно заряженных ионов растворителя (Н+ или ОН- соответственно) с поверхностями белковых частиц, заряженных положительно в кислой среде и отрицательно в щелочной, а значит и переход белков в раствор. В кислой среде белок имеет положительный заряд вследствие подавления диссоциации карбоксильных (–СООН) групп, в щелочной – отрицательный за счет подавления диссоциации основных (–NH2) групп.
Зависимость растворимости белков от концентрации солей носит нелинейный характер. При добавлении небольших количеств солей растворимость увеличивается, так как ионы препятствуют электростатическому взаимодействию боковых групп белка между собой. Высокие концентрации солей, снижающие гидратацию полипептидных цепей, наоборот, усиливают гидрофобные белок-белковые взаимодействия и вызывают выпадение белка в осадок (высаливание). Использование в качестве растворителя воды, разбавленных растворов солей, щелочей и водно-спиртовых растворов обеспечивает перевод гетерогенных смесей в раствор, соответственно, альбуминов, глобулинов, глютелинов и проламинов и получение белковых фракций, различающихся по аминокислотному составу, молекулярным массам и функциональным свойствам.
Различия в растворимости белков пищевого сырья лежат в основе технологических процессов выделения изолятов и концентратов и имеют непосредственное отношение к качеству многих пищевых продуктов. Важное значение растворимость белков имеет для повышения качества пищевых продуктов, в производстве которых предусмотрен их гидролиз (автолиз) и денатурация (начальные технологические стадии, сушка и хранение). Потеря растворимости, как правило, сопровождается изменением и других важных функциональных свойств, что в значительной мере отражается на качестве продуктов и степени перевариваемости белка в желудочно-кишечном тракте. Особые требования к растворимости белков предъявляются при использовании последних в производстве напитков, хлебных, мучных кондитерских и макаронных изделий. В напитках применяются белки с высокой растворимостью, в изделиях из муки – с низкой. Применение белков с чрезмерно высокой растворимостью в составе хлебопекарных улучшителей отрицательно отражается на эластично-вязкоупругих свойствах теста. Незначительное количество растворимого белка должно содержаться в текстурированных формах белка, зерновых продуктах, приготовленных высокотемпературной экструзией, и макаронных изделиях.
Свойства белковых суспензий. При использовании белков в качестве обогатителей, наполнителей (разбавителей), функциональных ингредиентов и аналогов мясных и рыбных изделий большое значение имеют такие свойства белковых суспензий, как ограниченная степень набухания и размер частиц, водо- и жиросвязывающая способность, адгезионные свойства, значение рН и буферная емкость, образование вязко-упругоэластичных масс и гелей.
Водосвязывающая способность характеризуется адсорбцией воды при участии гидрофильных остатков аминокислот, жиросвязывающая – адсорбцией жира за счет гидрофобных остатков. При невысокой влажности гидрофильные группы, взаимодействуя с молекулами воды, образуют мономолекулярный слой, при высокой – вокруг глобул белка формируется многослойная структура с одновременным проникновением воды во впадины и выступы. Общее количество воды и жира на поверхности достигает 0,2–0,4 г на 1 г белков.
Способность белков удерживать жир и воду зависит не только от особенностей аминокислотного состава и структуры, но и от фракционного состава, способа обработки, рН среды, температуры и присутствия углеводов, липидов и других белков. В пшеничном тесте при добавлении соевого белка или пшеничной клейковины водопоглотительная способность положительно коррелирует с количеством нерастворимой фракции белков и отрицательно – с содержанием растворимой. Высокая способность белков удерживать воду в пищевых продуктах (мясных, хлебобулочных и т.д.) повышает выход последних, удлиняет сроки хранения и улучшает текстуру. Денатурированные белки имеют пониженную водосвязывающую способность, и их применение отрицательно сказывается на качестве хлеба. Высокая жироудерживающая способность белков обеспечивает нежную и однородную текстуру изделий, исключает отделение жира, сморщивание изделий, уменьшает потери при варке и жарении.
Жироэмульгирующая и пенообразующая способности белков широко используются в практике получения жировых эмульсий и пен. Присутствие в одной белковой цепи гидрофобных и гидрофильных группировок обеспечивает распределение молекул определенным образом на границе раздела фаз вода–масло и вода–газ. Ориентация гидрофильных групп белка к воде, а гидрофобных – к маслу на границе раздела фаз в виде прочного адсорбционного слоя снижает поверхностное натяжение в дисперсных системах и делает их агрегативно устойчивыми и одновременно вязкими. Наиболее широко распространены пищевые эмульсии "масло в воде" (м/в) и "вода в масле" (в/м), называемые, соответственно, прямыми и обратными. В производстве новых форм белковой пищи большое значение приобрели и эмульсии "вода в воде" (в/в). Все виды эмульсий с белком получают механическим диспергированием одной жидкости в другой при помощи мешалок, гомогенизаторов, обеспечивающих в поле сил сдвига деформацию дисперсионной среды с образованием мелких частиц. Эмульгирующие свойства белков оценивают по эмульгирующей способности, эмульгирующей емкости, стабильности эмульсий и т.д., описание которых можно найти в специальной литературе.
Пены (дисперсные системы с газообразной фазой и жидкой или твердой средой) получают механическим распределением воздуха в растворе белка путем взбивания или за счет вскипания воды, понижения давления, обеспечения химических и микробиологических процессов в белоксодержащих пищевых системах. Так, белки клейковины образуют пену в хлебном тесте под действием диоксида углерода при брожении, а в кондитерском – за счет химических разрыхлителей при выделении аммиака и диоксида углерода. Пенообразующие свойства белков характеризуются пенообразующей способностью и стабильностью пены. Первый показатель измеряется объемом пены, отнесенным к массе белка, второй – периодом ее полураспада, то есть временем, необходимым для разрушения половины объема пены. Оба показателя зависят от рН среды, концентрации белка, солей, температуры, присутствия липидов, сахарозы, пищевых волокон, фракционного состава и строения белков. Для качества некоторых пищевых продуктов большое значение имеет размер пузырьков пен, который также зависит от технологических и других факторов. Глютенин пшеницы, например, образует пузырьки пены с большим размером, чем глиадин. После расщепления дисульфидных связей в глиадине и целой клейковине размер пузырьков не изменяется, в то время как у глютенина он уменьшается.
На основе жироэмульгирующих свойств растительные и животные белки применяются в производстве хлебобулочных, мучных кондитерских изделий, низкокалорийных маргаринов, майонезов, паст, мясных продуктов, а пенообразующие свойства являются основой производства сбивных кондитерских изделий (бисквитов, десертов, кремов и т. д.). Способность белковых суспензий к сцеплению с поверхностями металла, пластмасс, картона, бумаги (адгезия) важна в процессах транспортировки, обработки, формования и упаковки тестовых, творожных, сырных, конфетных масс, мясных и рыбных фаршей, текстуратов белка и новых форм белковой пищи (аналогов).
Гелеобразующие свойства белков характеризуются способностью их коллоидного раствора из свободно диспергированного состояния переходить в связнодисперсное (с образованием систем, обладающих свойствами твердых тел). Упругие свойства геля, обусловленные образованием пространственной сетки взаимодействующих молекул белка, зависят от минимальной его концентрации, при которой наступает гелеобразование (гель-точки), от рН, от присутствия других белков, солей, полисахаридов. Белок как гелеобразователь должен образовывать гели в широком диапазоне рН, ионной силы, при минимальной концентрации и с необходимыми физико-химическими свойствами. К последним относятся прочность, твердость, эластичность, тиксотропия (способность обратимо переходить в текучее состояние при механической обработке и вновь образовывать нетекучий гель после снятия нагрузки), температура размягчения и плавления, степень набухания, способность к синерезису (отделение дисперсионной среды с сокращением объема геля), сорбция красителей и ароматических веществ и т.д. К подобного рода "универсальным" гелеобразователям относится желатин, позволяющий в широких пределах обеспечить регулирование химического состава и биологическую ценность пищевых продуктов.
Различают наполненные, смешанные, комплексные, анизотропные гели и ксерогели. Наполненные гели содержат другие белки в суспензированном или растворенном виде, смешанные состоят из пространственных сеток с разными видами белков, у комплексных гелей роль гелеобразователя выполняют комплексы белков с другими соединениями. Отличительной особенностью анизотропных гелей является наличие в их составе ориентированных молекул белка, а ксерогелей (сухих гелей) – возможность хранения их в течение длительного времени.
Вязко-эластично-упругие свойства. Отличительным свойством некоторых пищевых белков является низкий уровень полярности функциональных групп. Молекулы воды, окружая частицы белков, отталкиваются, а молекулы белков, наоборот, агрегируются с образованием комплексов с присущими им реологическими свойствами (вязкость, эластичность, упругость). Наиболее выраженным комплексом таких свойств обладают белки пшеничной клейковины, обуславливающие текстуру хлеба и создающие непрерывную фазу в изделиях с наполнителями (зерно, отруби, изюм). За свойство упругости и эластичности белков ответственность несет глютениновая фракция белков.
С целью обеспечения стабильности технологического процесса, улучшения качества и расширения ассортимента пищевых изделий осуществляют регулирование функциональных свойств. Функциональные свойства белков определяются их структурой. Например, вязкость и гелеобразующие свойства соотносятся с размером и формой молекул, а водосвязывающая способность, пенообразующие и эмульгирующие свойства коррелируют с соотношением на поверхности полярных и гидрофобных групп. Все факторы, которые изменяют структуру белков, вызывают и регулирование (модификацию) их свойств.
Регулирование функциональных свойств белков достигается изменением условий их выделения, сушки, физическими, физико-химическими воздействиями, ферментативной и химической модификацией. Параметры обработки могут изменять аминокислотный и фракционный состав белков, вызывать денатурацию, агрегацию или взаимодействие с другими компонентами (липидами, углеводами).
Наиболее широко используемыми методами регулирования функциональных свойств являются физико-химические и ферментативные. К физико-химическим методам относятся перевод белков перед сушкой в раствор кислот, щелочей, оснований – с целью изменения заряда или ионного состава, тепловая денатурация и т.д. При этом у белков улучшаются функциональные свойства: повышается растворимость, гелеобразующая, жироэмульгирующая способность, способность к текстурированию и прядению.
Функциональные свойства белков улучшаются и за счет обработки их веществами липидной (лецитин, стеароил-2-лактилат натрия или кальция, моно- и диацилглицерины), углеводной (пектины, альгинаты, каррагинаны, камеди) или иной природы (поливалентные металлы).
Реакционные группы белков взаимодействуют с различными типами соединений с образованием при этом композитных формул. Последние усиливают процессы водопоглощения, эмульгирования жира, гелеобразования, структурирования и тем самым улучшают качество готовых изделий.
Хорошо изучено взаимодействие белков с заряженными полисахаридами, приводящее к получению нерастворимых электростатических комплексов. При этом наблюдается фазовое расслоение системы. Регулирование функциональных свойств белков в составе суспензии достигается добавлением в состав пищевых дисперсных систем, например мясных фаршей, анионных полисахаридов (пектаты, альгинаты, карбоксиметилцеллюлоза) или применением последних на стадии осаждения белка из растворов. Комплексообразование белков с полисахаридами эффективно и для избирательного фракционирования белковых компонентов за счет сорбции их как при одноименных, так и разноименных зарядах с молекулами анионов.
Комплексы белок – анионный полисахарид имеют большую набухаемость, хорошую водоудерживающую способность и более высокие поверхностно-активные свойства. В присутствии, например, пектина и каррагинана эмульсионная емкость и стабильность жировой эмульсии с казеинатом натрия повышаются (Э. Токаев, И. Рогов и др., 1982). Образование комплекса белок – анионный полисахарид (КМЦ, гуммиарабик и др.) с казеином, глобулинами сои обеспечивает и получение более стабильных пен при более высокой массовой доле белка в них (В. Толстогузов, Е. Браудо и др., 1985).
При образовании комплексов белка с анионными полисахаридами большая роль отводится взаимодействию положительно заряженных групп белка с отрицательно заряженными группами полисахаридов, а также образованию гидрофобных взаимодействий и водородных связей между комплексообразователями. При формировании таких комплексов иногда изменяется вторичная структура белка.
Ферментативная модификация функциональных свойств белков осуществляется с использованием ферментов (табл. 2.14) растительного, микробного или животного происхождения. Преимуществом таких методов являются мягкие режимы выделения белков, сохранение биологической ценности и возможность регулирования глубины той или иной реакции. К недостаткам методов относится ограничение процессов модификации из-за высокой степени специфичности ферментов.
Таблица 2.14.Методы ферментативной модификации белков [К. Швенке, 2000]
| Реакция | Фермент | Реагирующие функциональные группы | Структурные эффекты |
| Протеолиз | Протеиназы | Специфическое расщепление пептидных связей | Уменьшение молекулярной массы, гидрофилизация |
| Пластеиновая реакция | Протеиназы | Пептидные связи, -NH2 и -СООН | Транспептидация после ферментативного расщепления |
| Гликозилирование | Трансглугаминаза | -Glu-CO-NH2 | Гидрофилизация |
| Фосфорилироваие | Протеинкиназы | -ОН | Тоже |
| Дезамидирование | Пептидоглутаминазы, трансглутаминазы | -Glu-CO-NH2 | " " |
| Сшивание | Трансглутаминазы, | -Glu-CO-NH2 | Стабилизация структуры |
| пероксидаза, | Tyr | ||
| полифенолоксидаза | Tyr |
Из ферментативных методов модификации наибольшее распространение получил метод ограниченного ферментативного протеолиза. С его использованием для замены яичного альбумина выпускают пенообразующие модифицированные белки: гидролизаты изолята и гидролизаты муки.
При ограниченном протеолизе, например, легумина кормовых бобов под влиянием трипсина – фермента пищеварительного тракта – расщепляются пептидные связи только α-цепей, тогда как (β-цепи остаются незатронутыми. И только в ходе дальнейшего глубокого протеолиза β-цепи 11S белка расщепляются на пептиды.
Гидролитический распад гидрофильных а-цепей приводит к понижению молекулярной массы с 340 до 240 кДа и к возрастанию степени гидрофобности "Обрубка" – легумина Т. Молекулы белка становятся более компактными, сферическими и с высокой термодинамической стабильностью (Браудо Е. Е., 1997). При этом улучшаются эмульгирующие и пенообразующие свойства белков.
Аналогичная взаимосвязь между особенностями структуры 11S глобулинов, подвергнувшихся ограниченному протеолизу, и функциональными свойствами существует и у гороха и у сои. Разница заключается в молекулярных массах легумина Т – 230–260 кДа.
Определенный интерес представляют реакции ферментативного синтеза белков из пептидов (пластеиновый синтез), которые целесообразно применять для введения в состав белков незаменимых аминокислот или их производных (эфиров) с целью улучшения растворимости, поверхностно-активных свойств и биологической ценности:

Важнейшие химические методы модификации функциональных свойств приведены в табл. 2.15. Из этих методов широко известны приемы
Таблица 2.15.Методы химической модификации белков [К. Д. Швенке, 2000]
| Реакция | Реагирующие функциональные группы | Структурные эффекты |
| Ацетилирование | -NH2, -ОН, Tyr-OH, -SH | Гидрофобизация, изменение конформации при высоких степенях модификации |
| Сукцинилирование | -NH2, -ОН, (Tyr-OH, -SH)* | То же |
| Гликозилирование | -NH2 | Гидрофилизация |
| Фосфорилирование | -ОН, -NН2, Tyr-OH, (-COOH)* | Гидрофилизация, сшивание, гидрофобизация как результат изменения конформации |
| Дезамидирование | -СОNН2 | Гидрофилизация, гидрофобизация как результат изменения конформации |
| Этерификация | -СООН | Гидрофобизация |
* Продукты реакции нестабильны. дезамидирования (удаление амидных групп глютамина и аспарагина), ацилирования аминогрупп янтарным (сукцинилирование) или уксусным (ацетилирование) ангидридами и фосфорилирования.
Сукцинилирование и ацетилирование протекают по следующим схемам:
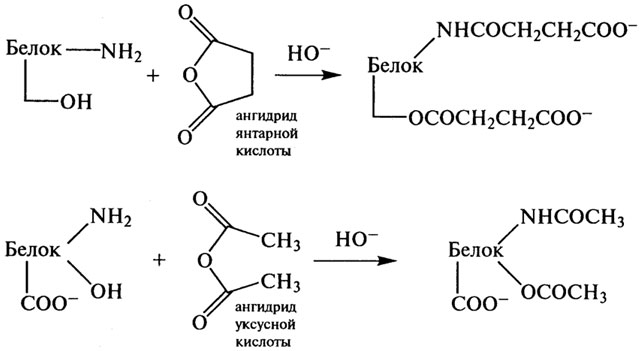
Данный вид химической модификации приводит к повышению суммарного отрицательного заряда молекулы из-за ковалентного присоединения остатков янтарной и уксусной кислот к ε-группам остатков лизина. Степень ацилирования возрастает за счет гидроксильных групп серина, треонина и тирозина.
Электростатическое отталкивание одноименно заряженных групп приводит к структурным изменениям в белках и даже распаду 11S белков на субъединицы и развертыванию их глобулярной структуры. Подобные структурные изменения характерны для 11S глобулинов семян арахиса, рапса, подсолнечника, гороха и кормовых бобов.
Благодаря изменению пространственной структуры и заряда молекул белков усиливаются гидрофобные свойства, следовательно, улучшаются эмульгирующие и пенообразующие свойства, изменяются растворимость и гелеобразующие свойства. Полипептидные цепи формируют гели при меньших значениях концентрации, рН и температуры, чем нативные белковые глобулы. С возрастанием степени модификации прочность гелей уменьшается, поэтому для ацетилированных белков целесообразна средняя степень модификации.
Сукцинилированные или ацетилированные легумины при определенной степени модификации образуют эмульсии "масло в воде" высокой степени устойчивости. Фосфорилирование растительных белков с применением хлорокиси фосфора приводит к улучшению растворимости, эмульгирующих и пенообразующих свойств и способности к гелеобразованию. Стабилизации структуры геля способствуют ковалентные сшивки модифицированных белков:
Белок-NНРОСl2 + НООС-Белок + 2Н2О → Бeлoк – NHCO – Бeлoк + 2НСl + Н3РО4
ПРЕВРАЩЕНИЯ БЕЛКОВ
В ТЕХНОЛОГИЧЕСКОМ ПОТОКЕ
Нативная трехмерная структура белков поддерживается разнообразием внутри- и межмолекулярных сил и поперечных связей. Любое изменение условий среды в технологических потоках производства пищевых продуктов оказывает влияние на нековалентные связи молекулярной структуры и приводит к разрушению четвертичной, вторичной и третичной структуры. Разрушение нативной структуры, сопровождающееся потерей биологической активности (ферментативной, гормональной), называют денатурацией. С физической точки зрения денатурацию рассматривают как разупорядочение конформации полипептидной цепи без изменения первичной структуры. Процесс денатурации протомера схематически представлен на рис. 2.17. Денатурация олигомерного белка заключается в диссоциации на протомеры, сопровождающейся или не сопровождающейся изменением их конформации.
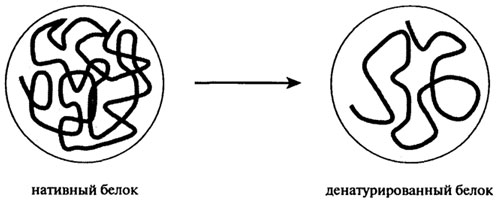
Рис. 2.17. Схема денатурации протомера
Большинство белков денатурируются в присутствии сильных минеральных кислот или оснований, при нагревании, охлаждении, обработке поверхностно-активными веществами (додецилсульфатом), мочевиной, гуанидином, тяжелыми металлами (Ag, Pb, Hg) или органическими растворителями (этанолом, метанолом, ацетоном). Широкое применение кислот, оснований, солей, органических растворителей предусматривается в практике выделения белков из пищевого сырья и готовых продуктов при изучении их свойств и структурных особенностей, а также при экстракции и очистке в технологии выделения концентратов и изолятов. Денатурированные белки обычно менее растворимы в воде, так как их полипептидные цепи настолько сильно переплетены между собой, что затрудняется доступ молекул растворителя к радикалам остатков аминокислот.
Большая часть белков денатурируется при 60–80°С, однако встречаются белки и термостабильные, например, α-лактоглобулин молока и α-амилазы некоторых бактерий. Повышенная устойчивость белков к нагреванию часто обуславливается наличием в их составе большого количества дисульфидных связей. Однако степень денатурирующего воздействия температуры на белки зависит и от их влажности, реакции и солевого состава среды и присутствия небелковых соединений. Например, температура денатурации белков сои и подсолнечника существенно понижается в присутствии кислот жирного ряда, в кислой и влажной среде, но повышается в присутствии сахарозы и крахмала.
Факторы, вызывающие денатурацию белков, имеют особо важное значение для регулирования активности ферментов. Любые воздействия, направленные на стабилизацию вторичной и третичной структуры, приводят к повышению активности ферментов, а те, которые разрушают нативную структуру, – к их инактивации.
При температуре от 40–60°С до 100°С со значительной скоростью протекает взаимодействие белков с восстанавливающими сахарами, сопровождающееся образованием карбонильных соединений и темноокрашенных продуктов – меланоидинов (реакция Майяра). Сущность реакций меланоидинообразования заключается во взаимодействии группы –NH2 аминокислот с гликозидными гидроксилами сахаров (см. гл. 3). Сахаро-аминные реакции являются причиной не только потемнения пищевых продуктов, но и уменьшения в них сухого вещества и потерь незаменимых аминокислот (лизина, треонина). Меланоидины понижают биологическую ценность изделий, так как снижается усвояемость аминокислот из-за того, что сахароаминные комплексы не подвергаются гидролизу ферментами пищеварительного тракта. К тому же количество незаменимых аминокислот уменьшается. Это уменьшение происходит не только за счет взаимодействия их с восстанавливающими сахарами, но и за счет взаимодействия между собой функциональных групп –NH2 и –СООН самого белка. Реакции протекают с образованием внутренних ангидридов, циклических амидов и ω–ε изопептидных связей. Механизм образования связей с участием глутаминовой кислоты и ее амида представлен на рис. 2.18. Изопептиды обнаружены в кератине, молочных белках и белках мяса.
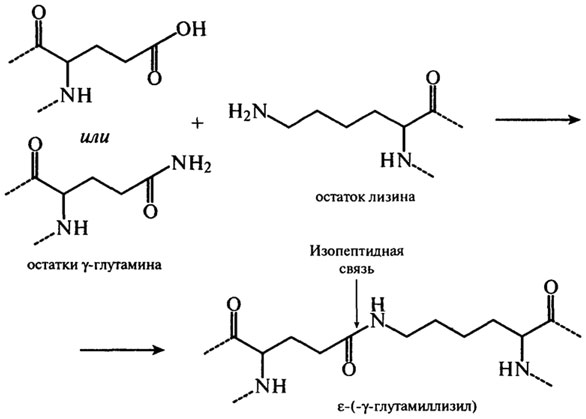
Рис. 2.18.Механизм образования изопептидных связей
Тепловая денатурация белков является одним из основных физико-химических процессов, лежащих в основе выпечки хлеба, печенья, бисквитов, пирожных, сухарей, сушки макаронных изделий, получения экструдатов и сухих завтраков, варки, жарения овощей, рыбы, мяса, консервирования, пастеризации и стерилизации молока. Данный вид превращений относится к полезным, так как он ускоряет переваривание белков в желудочно-кишечном тракте человека (облегчая доступ к ним протеолитических ферментов) и обуславливает потребительские свойства пищевых продуктов (текстуру, внешний вид, органолептические свойства). В связи с тем, что степень денатурации белков может быть различной (от незначительной до полного изменения расположения пептидных цепей с образованием новых ковалентных –S–S-связей), то и усвояемость полимеров может не только улучшаться, но и ухудшаться. Параллельно могут изменяться физико-химические свойства белков. Для хлопковых семян, подвергнутых влаготепловой обработке, зафиксирован, например, переход растворимого азота из одной формы в другую:
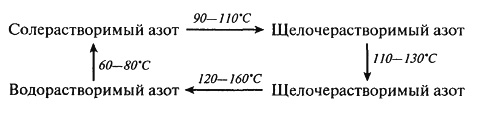
Термическая обработка белоксодержащей пищи при 100– 120°С приводит не к денатурации, а к разрушению (деструкции) макромолекул белка с отщеплением функциональных групп, расщеплением пептидных связей и образованием сероводорода, аммиака, углекислого газа и ряда более сложных соединений небелковой природы. Так, стерилизация молочных, мясных и рыбных продуктов при температуре выше 115°С вызывает разрушение цистеиновых остатков с отщеплением сероводорода, диметилсульфида и цистеиновой кислоты:
| H2S | CH3-S-CH3 | HO2C-CH(NH2)CH2SO3H |
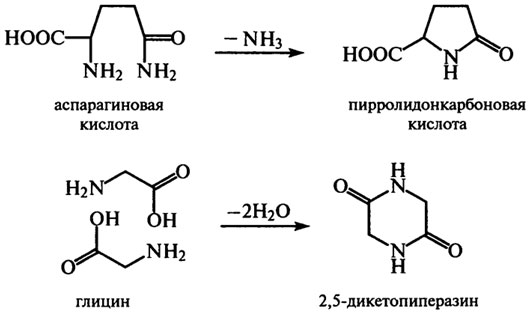
Реакции дезамидирования аспарагиновой и глутаминовой аминокислот и дегидратации глицина могут быть причиной образования новых ковалентных связей в белках, так как образуется пирролидонкарбоновая кислота и 2,5-дикетопиперазин (дикетопиперазина много в обжаренных бобах какао):
Среди продуктов термического распада белков встречаются соединения, придающие им мутагенные свойства. Термически индуцированные мутагены образуются в белоксодержащей пище в процессе ее обжаривания в масле, выпечки, копчения в дыму и сушки. Мутагены содержатся в бульонах, жареной говядине, свинине, домашней птице, жареных яйцах, копченой и вяленой рыбе. Некоторые из них вызывают наследственные изменения в ДНК, и их воздействие на здоровье человека может быть от незначительного до летального.
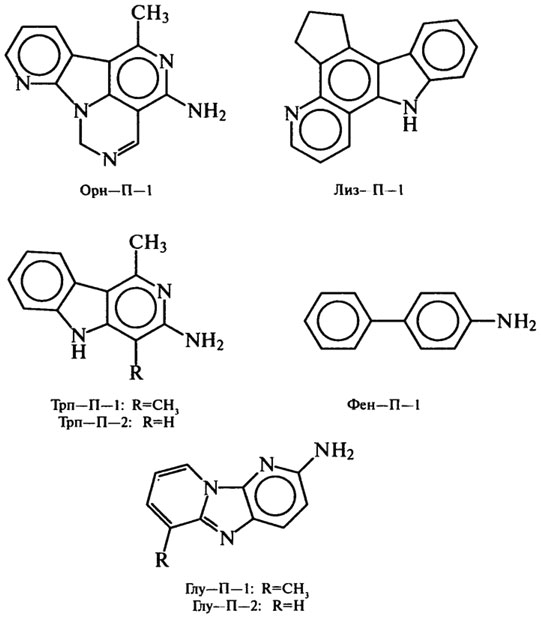
В экстрактах, выделенных из жареной рыбы и мяса, еще в 70-х гг. найдены продукты пирролиза аминокислот, образующиеся обычно при 500–600°С. Продукты идентифицированы как Трп–П–1 и Трп–П–2 из триптофана, Фен–П–1 из фенилаланина, Глу–П–1 и Глу–П–2 из глутаминовой кислоты, Лиз–П–1 из лизина, Орн–П–1 из орнитина:
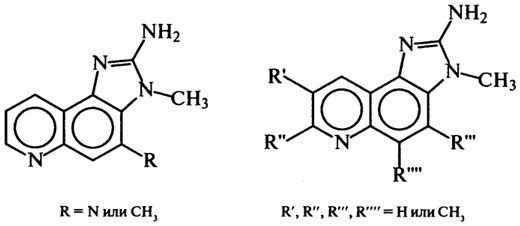
Другая группа мутагенных соединений в белковой пище открыта в 80-х гг. в умеренно нагретом мясе (ниже 200°С) и пищевых бульонах:
Токсические свойства белков при термической обработке выше 200°С или при более низких температурах, но в щелочной среде, могут обуславливаться не только процессами деструкции, но и реакциями изомеризации остатков аминокислот из L- в D-форму. Присутствие D-изомеров понижает усвояемость белков. Например, термообработка казеина молока при температуре около 200°С снижает биологическую ценность продукта на 50%.
В сильнощелочных средах, особенно при высоких температурах, некоторые остатки аминокислот претерпевают ряд специфических превращений. Так, аргинин превращается в орнитин, цитруллин, мочевину и аммиак, а цистеин – в дегидроаланин с выделением сероводорода:
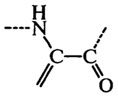
Реакционноспособный дегидроаланин конденсируется с остатками лизина, орнитина и цистеина боковых цепей и образует межмолекулярные поперечные связи в белках:
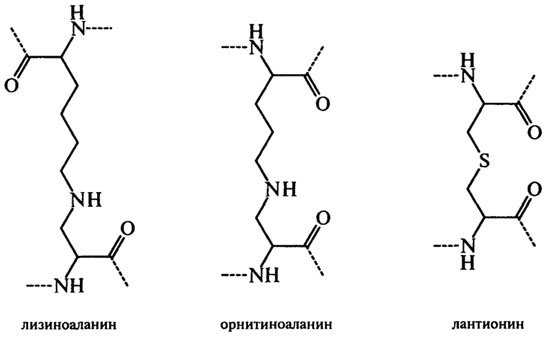
В реакцию конденсации могут вступать остатки аргинина, гистидина, треонина, серина, тирозина и триптофана. Питательная ценность белков с новыми поперечными связями ниже, чем у белков с нативной структурой, поэтому образование их в технологических процессах производства пищевых продуктов нежелательно. К тому же в опытах на крысах показано, что образование, например, лизиноаланина стимулирует нефрокальциноз, диарею и облысение. Обработка сырья растворами щелочей широко используется при получении изолятов и концентратов белков. Чем ниже значение рН, температура и время обработки, тем выше содержание незаменимых аминокислот в белке. Например, при повышении рН раствора с 8,5 до 12,5 при экстракции белка из пшеничных отрубей количество лизина в нем уменьшается на 40%, треонина – на 26%, а валина – на 24%. Мягкие температурные режимы предохраняют от образования в больших количествах нежелательных аминокислотных фрагментов. В то же время среди специалистов обсуждается вопрос о введении предельно допустимых концентраций лизиноаланина (например, 300 мг на 1 кг) в целях обеспечения безопасности белоксодержащей пищи.
Неблагоприятные погодные условия при созревании зерна, поражение его вредителями и микрофлорой, пониженная или повышенная температура при хранении и переработке сырья и полуфабрикатов, механические, физические и химические факторы (перемешивание, гомогенизация, замес, инфракрасное облучение, ультразвук, действие солей, диоксида углерода, газообразных азота и этилена и т. д.) усиливают структурные перестройки белков, которые могут разрушать природные белково-липидные взаимодействия. Высвобождающиеся липиды, подвергаясь окислительной порче, способны инициировать образование ковалентных меж- и внутримолекулярных связей в белках и новых полимерах:
| R – H + LO˙22; → R˙ + L02H; | R˙ + R˙ → R-R; | |
| R – R + LO˙2 → R – R˙ + L02H; | R – R˙ + R˙ → R-R-R | и т. д. |
Остатки тирозина в присутствии гидропероксидов (LO2H) могут превращаться в сульфоксиды и сульфоны, остатки цистеина – в сульфиновые, сульфоновые кислоты, а остатки триптофана – в гидрокси-β-индолилаланин и N-формилкинуренин. Все реакции окисления связаны с потерей незаменимых аминокислот. Окислительная порча белков особенно опасна при переработке масличного и жирового сырья. Торможение реакций можно достигать добавлением оксидантов, ферментных препаратов или повышением активности собственных ферментов сырья в целях вывода липидов из взаимодействия с белками.
Использование новых и традиционных технологических процессов без глубокого изучения влияния их на молекулярные основы структуры белков, с одной стороны, опасно для здоровья людей, а с другой – неэффективно с точки зрения обеспечения качества пищевых продуктов. Примером может служить научно обоснованное применение аскорбиновой кислоты для улучшения качества хлеба. По современным представлениям, аскорбиновая кислота, окисляясь кислородом воздуха в дегидроаскорбиновую кислоту, окисляет глютатион (Г-SH), превращая его в окисленную форму (Г-S-S-Г). Это предохраняет глютатион от участия в сульфгидрильно-дисульфидном взаимодействии с белками клейковины во время образования теста. Сульфгидрильные группы пшеничного белка взаимодействуют друг с другом с образованием дисульфидносвязанных белковых цепей и качество изделий улучшается.
Наряду с окислительными процессами в технологических процессах, предусматривающих механические или физические воздействия на белковые вещества сырья (замес, гомогенизация, ультразвук и т.д.), протекают и други
Дата добавления: 2016-12-16; просмотров: 3559;











