Белки масличных культур
У масличных семян основной запасающей тканью для белков и ли-пидов является паренхима семядолей (подсолнечник, хлопчатник, рапс), эндосперм (семена клещевины, кориандра) или одновременно паренхима семядолей и эндосперм (хлопчатник, лен). Запасные белки сосредоточены в простых алейроновых зернах (семена хлопчатника, рапса, горчицы) и сложных (подсолнечник, клещевина). Простые алейроновые зерна не содержат посторонних соединений, тогда как сложные включают белковую и небелковую части. Сложные алейроновые зерна подразделяются на два типа: зерна, содержащие глобоиды - К, Mg, Са-соли инозитфосфорной кислоты, и зерна, в состав которых входят глобоиды и кристаллоиды. Кристаллоиды расположены в центре алейроновых зерен и окружены аморфной белковой зоной. Алейроновое зерно имеет вакуольную природу, вокруг него сосредоточены липи-ды, находящиеся в клетке, покрытой клеточной оболочкой (рис. 2.15). На долю белка в составе сухой массы алейроновых зерен приходится 60-80% общего белка семени.
Содержание белков в семенах масличных культур составляет 14-37% на сухое вещество. В семенах подсолнечника белок содержится в количестве 15%, в ядре - 16-19%, семенах арахиса - 20-37%, конопли - 20-22%, рапсе - 25-26%, в ядрах клещевины - 18-20%, в ядрах хлопчатника - 34-37%. В белках семян масличных культур содержится 10-30% альбуминов и до 90% глобулинов. Белки алейроновых зерен (алейрины) представлены в основном глобулинами (80-97%) и незначительным количеством альбуминов и глютелинов (1-2%). Проламины в алейроновых зернах практически отсутствуют. Кристаллоид масличных культур (конопли - эдестин, клещевины, хлопчатника, мака) представляет собой также глобулины с молекулярной массой от 15 до 300 кД и выше. В небольших количествах в нем присутствуют минорные компоненты с молекулярной массой около 600 кД. Глобулины, как и альбумины, являются смесью индивидуальных белков. В табл. 2.9 приведены состав и молекулярные характеристики фракций глобулинов. 7S фракция глобулинов масличных семян, как и у бобовых, называется вицилином, 11S - легумином. Все фракции
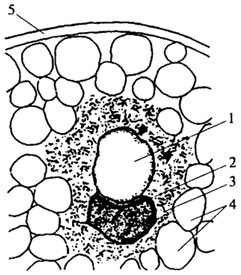
Рис. 2.15. Схема строения сложного алейронового зерна клетки масличного растения: 1- глобоид; 2 - белковый кристаллоид; 3 - аморфная белковая зона; 4 - липидные капли; 5 - клеточная оболочка
Таблица 2.9.Характеристика белковых компонентов масличных культур
| Культура | Коэффициент седиментации S20, В | Молекулярная масса белка, кД | Содержание белка, % |
| Подсолнечник | |||
| 20-50 | |||
| Рапс | 2 12 | 50-75 150-350 | |
| Хлопчатник | 15-50 | ||
| 180-200 | |||
| Арахис | 20-50 | 5-8 | |
| 142-190 | |||
отличаются друг от друга по аминокислотному составу и по соотношению кислых и основных субъединиц.
Аморфная зона алейроновых зерен является более гетерогенной по компонентному составу, чем кристаллоид. В составе этой зоны найдены гликопротеиды и белки с сильно выраженными основными свойствами, способные к образованию ионного комплекса с фитиновой кислотой. Физиологическая роль фитин-белковых комплексов и гликопротеидов на сегодняшний день до конца не ясна. Предполагают, что оба вида белковых образований легко мобилизуются в начале прорастания семян. Токсичный белок клещевины рицин также располагается в аморфной зоне алейроновых зерен.
Белки кристаллоида являются долговременной формой запаса, при прорастании семян они распадаются позже, чем белки аморфной зоны. В простых алейроновых зернах основные запасные белки также являются глобулинами, о чем свидетельствует их незначительная электрофоретическая гетерогенность и низкая ферментативная активность. Выяснение вопроса ферментативной активности семян имеет большое значение для понимания физиологической роли алейроновых зерен, чтобы ответить, являются ли они инертными хранилищами белка или представляют собой структуры лизосомного типа
В алейроновых зернах семян арахиса, клещевины и других культур показано присутствие фосфатазы, протеиназы, амилазы, липазы, причем в сложных алейроновых зернах ферменты локализованы в аморфной зоне. Эти данные, в соответствии с представлениями Кретовича, свидетельствуют об отсутствии метаболической инертности запасных белков. Однако для проверки этого положения требуются более глубокие исследования.
С вопросом возникновения и формирования алейроновых зерен тесно связан механизм отложения в запас белков в клетках семени. Полагают, что на первом этапе образования алейроновых зерен в вакуолях эндосперма появляются характерные структуры (полисомподобные частицы), на втором - образуется глобоид с отложением фитина внутри и "обрастанием" белком снаружи, на третьем - формируется кристаллоид. Таким образом, белки алейроновых зерен масличных культур представляют собой сложную гетерогенную систему, которая включает в себя как собственно запасные белки, так и некоторые гидролитические ферменты, участвующие, по-видимому, при гидролизе запасного белка и фитина при прорастании семян. Механизм отложения про запас белков при образовании алейроновых зерен разных типов различен, но в любом случае в процессе участвуют структурные элементы самих алейроновых зерен.
В настоящее время существует реальная возможность получения из масличного сырья концентрированных форм белка и создание на их основе новых форм белковой пищи. Целесообразность извлечения белка изданного вида сырья обусловлена его высокой массовой долей и разнообразным аминокислотным составом. Отличительной особенностью последнего является высокое количество триптофана, тирозина и фенил-аланина, а у некоторых культур - лизина (рапс), серосодержащих аминокислот (кунжут, подсолнечник, рапс) и треонина (рапс, подсолнечник); наиболее ценными в биологическом отношении являются белки рапса, подсолнечника и кунжута (см. табл. 2.10).
Большой практический интерес представляют изменения белковых веществ масличных культур при подготовке семян к переработке и извлечению масел на масло-жировых предприятиях (сушке, хранении, обрушивании, влаго-тепловой обработке, прессовании, экстракции) и при получении белковых концентратов и изолятов. Наиболее глубоко эти процессы изучены для подсолнечника. Уже на первых этапах сушки начинаются денатурационные изменения белков, которые приводят к снижению их биологической и пищевой ценности. При повышении температуры до 60-90°С резко снижается вязкость и гидролизуемость суммарного белка протеазами, так как изменившаяся структура под действием тепла делает недоступными пептидные связи, на которые направлено действие этих ферментов.
Таблица 2.10.Состав незаменимых аминокислот важнейших масличных семян
| Незаменимые аминокислоты | Семена, мг на 1 г белка | ||||
| Подсолнечник | Арахис | Рапс (высокоэруковый) | Кунжут | Хлопчатник | |
| Валин | |||||
| Изолейцин | |||||
| Лейцин | |||||
| Лизин | |||||
| Треонин | |||||
| Метионин + цистин | |||||
| Фенилаланин + тирозин | |||||
| Триптофан |
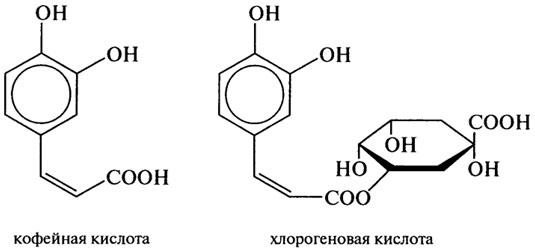
Изменения структуры белковых молекул при влажно-тепловой обработке, измельчении семян, просеивании и экстракции вызывают изменения во фракционном составе белков. Количество альбуминов в шроте снижается в два раза, соответственно увеличивается доля глютелинов. Повышение температуры снижает содержание лизина, метионина в глю-телиновой фракции белка на 15-30% в зависимости от вида сырья и технологических режимов, включая приемы, направленные на исключение присутствия нежелательных компонентов в шроте (госсипол хлопчатника, хлорогеновая и кофейная кислоты подсолнечника). Денатурацион-ные изменения в процессе влажно-тепловой обработки на этапах подготовки семян при извлечении масел приводят к уменьшению количества электрофоретических компонентов с высокой подвижностью и низкой молекулярной массой.
В масличных семенах и шротах содержатся антипитательные вещества белковой природы, которые понижают пищевую ценность концентратов, изолятов или кормовую ценность, если шрот используется в качестве корма для животных. К таким веществам относятся ингибиторы трипсина арахиса, рицин клещевины, протеазы, уреаза и липоксигеназа. Рицин, как и соин, вызывает гемагглютинацию крови; содержание его в семенах зависит от сорта клещевины. Инактивация токсичных компонентов белковой природы достигается применением влаго-тешювой обработки.
Белки масличных культур в процессе переработки сырья при повышенных температурах в нейтральных и слабощелочных средах способны к взаимодействию с другими компонентами, например с полифеноль-ными соединениями. В процессе экстракции белка при получении концентратов и изолятов хлорогеновая и кофейная кислоты подсолнечника и госсипол хлопчатника окисляются в орто-фенолы, полимеризующие-ся с образованием коричневых пигментов.
Полифенольные соединения имеют следующее строение:
Полифенольные соединения взаимодействуют с белком при помощи водородных и ковалентных связей при участии остатков лизина, триптофана и серосодержащих аминокислот. В результате белковые продукты окрашиваются в зеленовато-коричневый цвет, их биологическая ценность снижается, функциональные и органолептические свойства изменяются.
Дата добавления: 2016-12-16; просмотров: 2160;











