Некоторые биогенные гидроксикарбоновые кислоты и их кислотные свойства
| Формула | Тривиальное название кислоты | Название солей | Кислотные свойства |
| * СН3—СН—СООН | ОН | Молочная | Лактаты | рКа = 3,06 |
| * НООС—СН2— СН— СООН | ОН | Яблочная | Малаты | pК 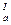 =3,5
рК =3,5
рК 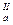 =5,0 =5,0
|
| * * НООС—СН— СН— СООН | | ОН ОН | Винная | Тартраты | pК 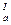 =2,93
рК =2,93
рК 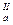 =4,23 =4,23
|
| СООН | НООС- СН2—С— СН2- СООН | ОН | Лимонная | Цитраты | pК 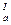 =3,1
рК =3,1
рК 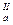 =4,7
рК =4,7
рК 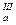 =6,4 =6,4
|
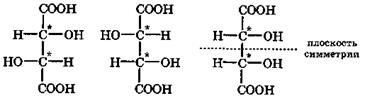
Примечание. Звездочкой отмечены хиральные центры, т. е. асимметрические углеродные атомы.
По взаимному расположению функциональных групп гидроксикислоты подразделяются на α-, β-, γ-кислоты и т. д:
СН3—СН2—СНСООН СН3—СН—СН2СООН СН2—СН2—СН2СООН
| | |
ОН ОН ОН
α -гидроксимасляная β-гидроксимасляная γ-гидроксимасляная
кислота кислота кислота
Многие гидроксикислоты, например молочная, яблочная, винная, изолимонная, имеют в молекуле хиральные центры, вследствие чего для них характерна оптическая изомерия. Так, молочная кислота существует в трех формах: две оптически активные, т. е. энантиомеры (зеркальные изомеры), а третья - оптическая неактивная, являющаяся рацемической смесью энантиомеров. Молочная кислота, выделенная из мышечной ткани, называемая мясо-молочной кислотой, является L-энантиомером. D-Молочная кислота образуется из сахаров при помощи особых бактерий-возбудителей брожения. Под действием молочнокислых бактерий в прокисшем молоке, при созревании сыров, при квашении овощей и в процессе силосования образующаяся молочная кислота является рацемической смесью обоих энантиомеров и не проявляет оптической активности:
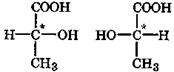
|
D-молочная L-молочная
кислота кислота

D,L – молочная кислота
(D,L-рацемат)
|
D-винная L-винная мезовинная кислота
 кислота кислота (оптически неактивная)
кислота кислота (оптически неактивная)
виноградная кислота
(D,L-рацемат)
Яблочная кислота подобно молочной также существует в трех формах: D-энантиомер, L-энантиомер и их D, L-рацемат.
Молекула винной кислоты содержит два одинаковых хиральных центра, между которыми может проходить плоскость симметрии этой молекулы. Поэтому винная кислота в природе существует в четырех формах: D-винная, L-винная, D,L-рацемат, называемый виноградной кислотой, а также мезовинная кислота, являющаяся оптически неактивным стереоизомером вследствие внутримолекулярной компенсации из-за симметричности ее структуры. Оптические изомеры гидроксикислот отличаются не только физическими свойствами, но и тем, что их биологические и физиологические функции различны. В организме обычно присутствует один стереоизомер гидроксикислоты.
Среди специфических свойств гидроксикислот прежде всего следует отметить их склонность к реакции дегидратации при нагревании. При этом дегидратация для α-, β- и γ-гидроксикислот происходит различно.
|
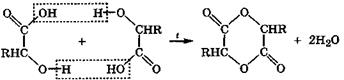
α-Гидроксикислоты дегидратируются межмолекулярно, при этом спиртовые группы взаимодействующих молекул взаимно ацилируются карбоксильными группами этих кислот с образованием устойчивых циклических сложных эфиров, называемых лактидами (от латинского названия молочной кислоты):
лактид
В этой электрофильно-нуклеофильной реакции каждая молекула за счет спиртовой группы выступает нуклеофилом, а за счет карбоксильной группы - электрофилом. Лактиды, как и сложные эфиры, при кипячении с водой в присутствии кислот или щелочей гидролизуются с образованием исходных кислот.
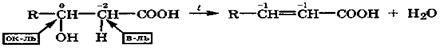
|
β-Гидроксикислоты при нагревании дегидратируются внутримолекулярно за счет протона α-метиленовой группы, имеющего повышенную подвижность, образуя α,β -непредельные кислоты:
Эта реакция сопровождается внутримолекулярной окислительно-восстановительной дисмутацией за счет углеродных атомов. Подобные реакции дегидратации протекают в организме при участии дегидратаз. Они имеют место при β-окислении жирных кислот и дегидратации лимонной кислоты в цикле Кребса.
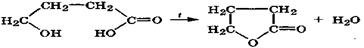
|
γ- и δ-Гидроксикислоты, вследствие пространственной близости —ОН и СООН-групп, очень неустойчивы и легко отщепляют молекулу воды вследствие внутримолекулярного ацилирования спиртовой группы с образованием устойчивых пяти- и шестичленных циклических внутренних сложных эфиров -лактонов:
γ-гидроксимасляная γ-бутиролактон
кислота
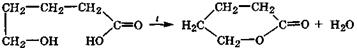
|
δ-гидроксивалериановая δ-валеролактон
кислота
Наличие в гидроксикислотах двух или более электроотрицательных групп способствует реакциям окислительно-восстановительной дисмутации, так как в их молекулах увеличивается число углеродных атомов, имеющих промежуточные степени окисления. Внутримолекулярная окислительно-восстановительная дисмутация α-гидроксикис-
лот происходит при их нагревании в присутствии H2SО4 и сопровождается разрывом связи С—С. При этом образуются муравьиная кислота и соответствующее карбонильное производное — альдегид или кетон:
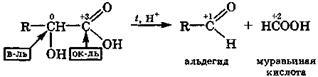
|
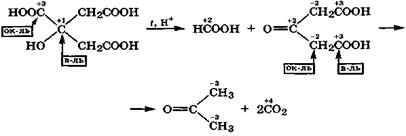
Лимонная кислота в этих условиях, наряду с муравьиной кислотой, образует ацетондикарбоновую кислоту, которая в результате внутримолекулярной окислительно-восстановитель
|
ной дисмутации легко декарбоксилируется с образованием ацетона:
Приведенные реакции еще раз демонстрируют, что углеродный атом карбоксильной группы может быть и окислителем (первая реакция), и восстановителем (вторая реакция).
В организме гидроксикислоты дегидрируются под действием дегидрогеназ с окисленной формой кофермента НАД+, причем водородные атомы отщепляются от спиртовой группы и связанного с ней углеродного атома. При этом образуются соответствующие оксокислоты.
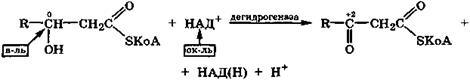
|
Так, важной стадией β-окисления жирных кислот является дегидрирование β-гидроксикислот в виде производных с коферментом А в соответствующие производные β-оксокислот.
Подобная реакция межмолекулярной окислительно-восстановительной дисмутации протекает с изолимонной кислотой в цикле Кребса:
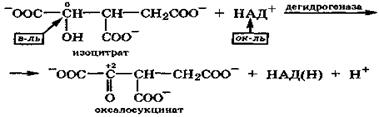
|
Таким образом, гидроксикислоты чрезвычайно склонны к реакциям окислительно-восстановительной дисмутации, протекающей как внутримолекулярно, так и межмолекулярно.
Дата добавления: 2019-09-30; просмотров: 673;











