Теория кристаллического поля
Теория кристаллического поля пришла на смену теории валентных связей в 40-х годах XX столетия. В чистом виде она сейчас не применяется, так как не может объяснить образование ковалентных связей в комплексных соединениях и совершенно не учитывает истинного состояния лигандов (например, их действительных размеров) даже в случае взаимодействий, близких к чисто электростатическим.
Уже с середины 50-х годов упрощенная теория кристаллического поля была заменена усовершенствованной теорией поля лигандов, учитывающей ковалентный характер химических связей между комплексообразователем и лигандом.
Однако наиболее общий подход к объяснению образования комплексных соединений дает теория молекулярных орбиталей (МО), которая в настоящее время превалирует над всеми остальными. Метод молекулярных орбиталей предусматривает и чисто электростатическое взаимодействие при отсутствии перекрывания атомных орбиталей, и всю совокупность промежуточных степеней перекрывания.
Рассмотрим основные понятия теории кристаллического поля, которая, как и теория валентных связей, все еще сохраняет свое значение для качественного описания химических связей в комплексных соединениях из-за большой простоты и наглядности.
В теории кристаллического поля химическая связь комплексообразователь – лиганд считается электростатической. В соответствии с этой теорией лиганды располагаются вокруг комплексообразователя в вершинах правильных многогранников (полиэдров) в виде точечных зарядов. Реальный объем лиганда теорией во внимание не принимается.
Лиганды, как точечные заряды, создают вокруг комплексообразователя электростатическое поле (“кристаллическое поле”, если рассматривать кристалл комплексного соединения, или поле лигандов), в котором энергетические уровни комплексообразователя и прежде всего d-подуровни расщепляются, и их энергия изменяется. Характер расщепления, энергия новых энергетических уровней зависит от симметрии расположения лигандов (октаэдрическое, тетраэдрическое или иное кристаллическое поле). Когда в качестве лигандов координируются молекулы H2O, NH3, CO и другие, их рассматривают как диполи, ориентированные отрицательным зарядом к комплексообразователю.
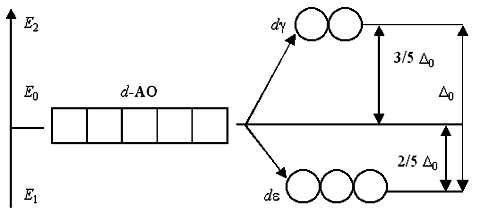
Рассмотрим случай октаэдрического расположения лигандов (например, [CoF6]-3 или [Co(NH3)6]3+). В центре октаэдра находится ион-комплексообразователь М(+n) с электронами на d-атомных орбиталях, а в его вершинах – лиганды в виде точечных отрицательных зарядов (например, ионы F- или полярные молекулы типа NH3). В условном ионе М(+n), не связанном с лигандами, энергии всех пяти d-АО одинаковы (т.е. атомные орбитали вырожденные).
Однако в октаэдрическом поле лигандов d-АО комплексообразователя попадают в неравноценное положение. Атомные орбитали d(z2) и d(х2-у2), вытянутые вдоль осей координат, ближе всего подходят к лигандам. Между этими орбиталями и лигандами, находящимися в вершинах октаэдра, возникают значительные силы отталкивания, приводящие к увеличению энергии орбиталей. Иначе говоря, данные атомные орбитали подвергаются максимальному воздействию поля лигандов. Физической моделью такого взаимодействия может служить сильно сжатая пружина.
Другие три d-АО – d(xy), d(xz) и d(yz), расположенные между осями координат и между лигандами, находятся на более значительном расстоянии от них. Взаимодействие таких d-АО с лигандами минимально, а следовательно – энергия d(xy), d(xz) и d(yz)-АО понижается по сравнению с исходной.
Таким образом, пятикратно вырожденные d-АО комплексообразователя, попадая в октаэдрическое поле лигандов, подвергаются расщеплению на две группы новых орбиталей – трехкратно вырожденные орбитали с более низкой энергией, d(xy), d(xz) и d(yz), и двукратно вырожденные орбитали с более высокой энергией, d(z2) и d(х2-у2). Эти новые группы d-орбиталей с более низкой и более высокой энергией обозначают dε и dγ:
d(z2) и d(х2-у2)
d(xy), d(xz),d(yz)
Разность энергий двух новых подуровней dε и dγ получила название параметра расщепления Δ0:
E2 – E1 = Δ0 ≈ 0
Расположение двух новых энергетических подуровней dε и dγ по отношению к исходному (d-АО) на энергетической диаграмме несимметричное:
(Е2 – Е0) > (Е0 – Е1).
Квантово-механическая теория требует, чтобы при полном заселении новых энергетических уровней электронами общая энергия осталась без изменения, т.е. она должна остаться равной Е0.
Иначе говоря, должно выполняться равенство
4(Е2 – Е0) = 6(Е0 – Е1),
где 4 и 6 – максимальное число электронов на dγ- и dε-АО. Из этого равенства следует, что
(Е2 – Е0) / (Е0 – Е1) = 3/2 и
(Е2 – Е1) / (Е0 – Е1) = 5/2, или
Δ0 / (Е0 – Е1) = 5/2, откуда (Е0 – Е1) = 2/5Δ0.
Размещение каждого электрона из шести максимально возможных на dε-орбитали вызывает уменьшение (выигрыш) энергии на 2/5 Δ0.
Наоборот, размещение каждого электрона из четырех возможных на dγ-орбитали вызывает увеличение (затрату) энергии на 3/5 Δ0.
Если заселить электронами dε- и dγ-орбитали полностью, то никакого выигрыша энергии не будет (как не будет и дополнительной затраты энергии).
Но если исходная d-АО заселена только частично и содержит от 1 до 6 электронов, и эти электроны размещаются только на dε-АО, то мы получим значительный выигрыш энергии.
Выигрыш энергии за счет преимущественного заселения электронами dε-атомных орбиталей называют энергией стабилизации комплекса полем лигандов.
Специфика каждого из лигандов сказывается в том, какое поле данный лиганд создает – сильное или слабое. Чем сильнее поле лигандов, чем больше значение параметра расщепления Δ0.
Изучение параметра расщепления, как правило, основано на спектроскопических исследованиях. Длины волн полос поглощения комплексов в кристаллическом состоянии или в растворе, обусловленные переходом электронов с dε- на dγ-АО, связаны с параметром расщепления Δ0 следующим образом:
λ = c / ν; Δ0 = Е2 – Е1 = h ν = h · (c / λ),
где постоянная Планка h равна 6,6260693 ∙ 10-34 Дж · с;
скорость света с = 3 · 1010 см/с.
Единица измерения Δ0 – та же, что у волнового числа: см-1, что приближенно отвечает 12 Дж/моль. Параметр расщепления, помимо типа лиганда, зависит от степени окисления и природы комплексообразователя.
В комплексных соединениях, включающих комплексообразователи одного и того же периода и в одинаковой степени окисления, с одними и теми же лигандами, параметр расщепления примерно одинаков. С ростом степени окисления комплексообразователя значение Δ0 увеличивается. Так, для аквакомплексов [Mn(H2O)6]2+ и [Fe(H2O)6]2+ значение параметра расщепления составляет 7800 и 10400 см-1, а для [Mn(H2O)6]3+ и [Fe(H2O)6]+3 13700 и 21000 см-1 соответственно. При увеличении заряда ядра атома-комплексообразователя Δ0 тоже растет. Катионы гексаамминкобальта(III) [Co(NH3)6]3+, гексаамминродия(III) [Rh(NH3)6]3+, гексаамминиридия(III) [Ir(NH3)6]3+ (Z = 27, 45 и 77) характеризуются параметрами расщепления, равными 22900, 34100 и 41000 см-1.
Зависимость Δ0 от природы лигандов более разнообразна. В результате исследования многочисленных комплексных соединений было установлено, что по способности увеличивать параметр расщепления металлов-комплексообразователей, находящихся в своих обычных степенях окисления, наиболее распространенные лиганды можно расположить в следующий спектрохимический ряд, вдоль которого значение Δ0 монотонно растет:
I > Br > Cl > NCS- ≈ NO3- > F- > OH- >H2O > H- > NH3 > NO2- > CN- > NO > CO.
Таким образом, наиболее сильное электростатическое поле вокруг комплексообразователя и самое сильное расщепление d-АО вызывают лиганды CN- , NO и CO. Рассмотрим распределение электронов по dε- и dγ-орбиталям в октаэдрическом поле лигандов. Заселение dε- и dγ-орбиталей происходит в полном соответствии с правилом Гунда и принципом Паули. При этом независимо от значения параметра расщепления первые три электрона занимают квантовые ячейки dε-подуровня:
 dγ
dγ
 dε
dε
Если число электронов на d-подуровне комплексообразователя больше трех, для размещения их по расщепленным подуровням появляется две возможности. При низком значении параметра расщепления (слабое поле лигандов) электроны преодолевают энергетический барьер, разделяющий dε- и dγ-орбитали; четвертый, а затем и пятый электроны заселяют квантовые ячейки dγ-подуровня.
 dγ
dγ
 dε
dε
При сильном поле лигандов и высоком значении Δ0 заселение четвертым и пятым электроном dγ-подуровня исключено; происходит заполнение dε-орбиталей.
 dγ
dγ
 dε
dε
При слабом поле лигандов заселяющие квантовые ячейки 4 или 5 электронов имеют параллельные спины, поэтому получаемый комплекс оказывается сильно парамагнитен. В сильном поле лигандов образуются одна, а затем две электронные пары на dε-подуровне, так что парамагнетизм комплекса оказывается гораздо слабее. Шестой, седьмой и восьмой электроны в случае слабого поля оказываются снова на dγ-подуровне, дополняя конфигурации до электронных пар (одной в случае d6, двух – d7 и трех – d8):
 dγ
dγ
 dε
dε
В случае сильного поля лигандов шестой электрон заселяет dε-АО, приводя к диамагнетизму комплекса, после чего седьмой и восьмой электроны поступают на dγ-подуровень:
 dγ
dγ
 dε
dε
Очевидно, при восьмиэлектронной конфигурации различия в строении между комплексами с лигандами слабого и сильного поля исчезают. Заселение орбиталей девятым и десятым электроном также не различается для комплексов обоих типов:
 dγ
dγ
 dε
dε
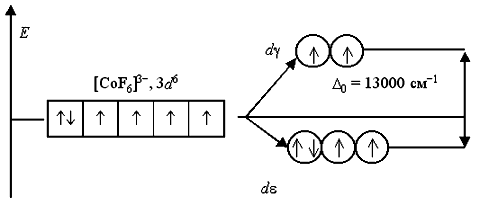
Вернемся к рассмотрению электронного строения октаэдрических комплексных ионов [Co(NH3)6]3+ и [CoF6]-3. В соответствии с расположением в спектрохимическом ряду, аммиак NH3 относится к числу лигандов сильного поля, а фторид-ион F- – слабого поля. В анионе [CoF6]-3 лиганды F- создают слабое кристаллическое поле (Δ0 = 13000 cм-1), и все электроны исходной 3d6-АО размещаются на dε- и dγ-орбиталях без какого-либо спаривания. Комплексный ион является высокоспиновым и содержит четыре неспаренных электрона, поэтому он парамагнитен:
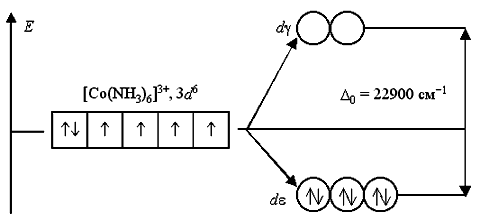
В ионе [Co(NH3)6]3+ лиганды NH3 создают сильное кристаллическое поле (Δ0= 22900 см-1), все 3d6-электроны размещаются на более энергетически выгодной dε-орбитали. Переход электронов с dε- на dγ-орбитали невозможен из-за слишком высокого энергетического барьера. Поэтому данный комплексный катион является низкоспиновым, он не содержит неспаренных электронов и диамагнитен:
Аналогичным образом могут быть представлены схемы распределения электронов по орбиталям в октаэдрическом поле для ионов [Fe(H2O)6]2+ и [Fe(CN)6]-4:
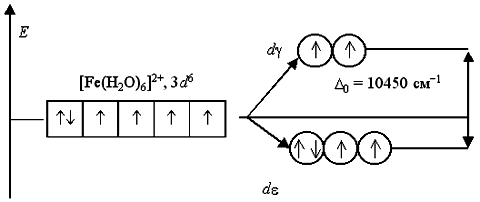
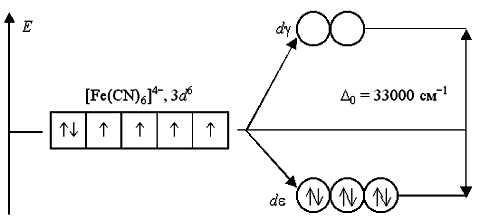
Лиганды H2O создают слабое поле; обмен электронами между dε- и dγ-орбиталями не вызывает затруднений и поэтому число неспаренных электронов в комплексном ионе такое же, как и в условном ионе Fe+II. Получаемый аквакомплекс – высокоспиновый, парамагнитный.
Наоборот, лиганды CN- вызывают значительное расщепление d-АО, составляющее 33000 см-1. Это значит, что существует сильная тенденция к размещению всех электронов на dε-орбиталях. Выигрыш энергии, получаемый при таком заселении орбиталей, много больше энергетических затрат, обусловленных спариванием электронов.
C позиции метода валентных связей в гибридизации валентных орбиталей, образующих связь в аквакомплексе участвуют d-АО внешнего подуровня (4sp3d2), а в низкоспиновом ― d-АО внутреннего подуровня (3d24sp3).
Таким образом, в высокоспиновых комплексах с лигандами слабого поля осуществляется гибридизация с участием d-АО внешнего подуровня, а низкоспиновых с лигандами сильного поля ― d-АО внутреннего подуровня. Количество неспаренных электронов в комплексе возможно определить методом электронного парамагнитного резонанса (ЭПР). С помощью приборов данного метода, называемых ЭПР спектрометрами, исследуются парамагнитные вещества.
Теория кристаллического поля позволяет объяснить появление той или иной окраски у комплексных соединений. Среди комплексных соединений значительное количество в кристаллическом состоянии и водном растворе отличаются яркой окраской. Так, водный раствор, содержащий катионы [Cu(NH3)4]2+, окрашен в интенсивно синий цвет, катионы [Ti(H2O)6]3+ придают раствору фиолетовую окраску, а катионы [Co(NH3)5H2O]2+ красную. Если через раствор или кристаллический образец вещества пропускать свет видимой части спектра, то в принципе возможны три варианта физического поведения образца: отсутствие поглощения света любой длины волны (образец вещества бесцветен, хотя может иметь полосы поглощения в ультрафиолетовой области спектра); полное поглощение света во всем интервале длин волн (образец будет казаться черным); наконец, поглощение света только определенной длины волны (тогда образец будет иметь цвет, дополнительный к поглощенному узкому участку спектра).

Таким образом, цвет раствора или кристаллов определяется частотой полос поглощения видимого света. Поглощение квантов света комплексами (например, имеющими октаэдрическое строение) объясняется взаимодействием света с электронами, находящимися на dε-подуровне, сопровождаемое их переходом на вакантные орбитали dγ-подуровня. Например, при пропускании света через водный раствор, содержащий катионы гексаакватитана(III) [Ti(H2O)6]3+, обнаруживается полоса поглощения света в желто-зеленой области спектра (20300 см-1, λ=500 нм). Это связано с переходом единственного электрона комплексообразователя с dε-АО на dγ-подуровень:
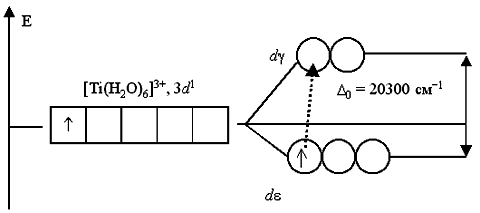
Поэтому раствор, содержащий [Ti(H2O)6]3+, приобретает фиолетовый цвет (дополнительный к поглощенному желто-зеленому). Раствор соли ванадия [V(H2O)6]Cl3 имеет зеленый цвет. Это также обусловлено соответствующими переходами электронов при поглощении ими части энергии светового луча. В основном состоянии, при электронной конфигурации ванадия(III) 3d2, два неспаренных электрона занимают dε-подуровень:
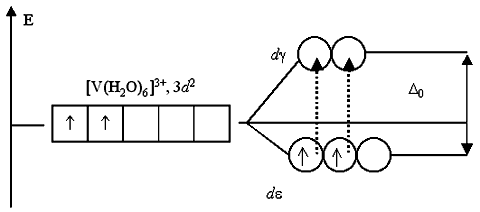
Существует всего два варианта перехода двух электронов на dγ-подуровень: либо оба электрона занимают dγ-АО, либо только один из них. Любые другие переходы электронов, связанные с уменьшением суммарного спина, запрещены.
Указанным переходам электронов, получивших избыточную энергию, соответствует полоса поглощения около 400 нм в спектре поглощения раствора хлорида гексаакваванадия(III). Поглощение пурпурно-фиолетовой области спектра дает дополнительный цвет раствора – ярко-зеленый. Если комплексообразователь имеет электронную конфигурацию d0 или d10, то переходы электронов с dε- на dγ-подуровень или наоборот невозможны либо из-за отсутствия электронов, либо из-за отсутствия вакантных орбиталей. Поэтому растворы комплексов с такими комплексообразователями, как Sc(III) (3d0), Cu(I) (3d10), Zn(II) (3d10), Cd(II) (4d10) и т.п., не поглощают энергии в видимой части спектра и кажутся бесцветными. Избирательность поглощения света зависит не только от комплексообразователя и степени его окисления, но и от вида лигандов. При замене в комплексном соединении лигандов, находящихся в левой части спектрохимического ряда, на лиганды, создающие сильное электростатическое поле, наблюдается увеличение доли энергии, поглощаемой электронами из проходящего света и как следствие – уменьшение длины волны соответствующей полосы поглощения. Так, водный раствор, содержащий катионы тетрааквамеди(II) [Cu(H2O)4]2+, окрашен в голубой цвет, а раствор сульфата тетраамминмеди(II) [Cu(NH3)4]2+ имеет интенсивно синюю окраску.
Дата добавления: 2021-03-18; просмотров: 913;











