Теория валентных связей
Теория валентных связей была первой из квантовомеханических теорий, использованной для приближенного объяснения характера химических связей в комплексных соединениях. В основе ее применения лежала идея о донорно-акцепторном механизме образования ковалентных связей между лигандом и комплексообразователем. Лиганд считается донорной частицей, способной передать пару электронов акцептору – комплексообразователю, предоставляющему для образования связи свободные квантовые ячейки (атомные орбитали) своих энергетических уровней.
Для образования ковалентных связей между комплексообразователем и лигандами необходимо, чтобы вакантные s-, p- или d-атомные орбитали комплексообразователя подверглись гибридизации определенного типа. Гибридные орбитали занимают в пространстве определенное положение, причем их число соответствует координационному числу комплексообразователя.
При этом часто происходит объединение неспаренных электронов комплексообразователя в пары, что позволяет высвободить некоторое число квантовых ячеек – атомных орбиталей, которые затем участвуют в гибридизации и образовании химических связей.
Неподеленные пары электронов лигандов взаимодействуют с гибридными орбиталями комплексообразователя, и происходит перекрывание соответствующих орбиталей комплексообразователя и лиганда с появлением в межъядерном пространстве повышенной электронной плотности. Электронные пары комплексообразователя, в свою очередь, взаимодействуют с вакантными атомными орбиталями лиганда, упрочняя связь по дативному механизму. Таким образом, химическая связь в комплексных соединениях является обычной ковалентной связью, достаточной прочной и энергетически выгодной.
Электронные пары, находящиеся на гибридных орбиталях комплексообразователя, стремятся занять в пространстве такое положение, при котором их взаимное отталкивание будет минимально. Это приводит к тому, что структура комплексных ионов и молекул оказывается в определенной зависимости от типа гибридизации(Табл. 4.1.). Рассмотрим образование некоторых комплексов с позиций теории валентных связей. Прежде всего отметим, что валентные орбитали атомов комплексообразователей близки по энергии.
Таблица 4.1. Тип гибридизации и геометрия некоторых комплексных соединений
E(n-1)d ≈ Ens ≈ Enp ≈ End
| Тип гибридизации | КЧ | Геометрия комплекса | Примеры |
| sp | линейная | [Ag(CN)2]- [Cu(NH3)2]+ | |
| sp2 | треугольная | [HgI3]- | |
| sp3 | тетраэдр | [Ni(CO)4]0 [Be(OH)4]2- [MnCl4]2- [Zn(NH3)4]2+ | |
| dsp2 | квадрат | [Ni(CN)4]2- [PtCl4]2- [Pt(NH3)2Cl2]0 [Cu(NH3)4]2+ | |
| sp3d(z2) | тригональная бипирамида | [Fe(CO)5] | |
| sp3 d(х2-у2) | квадратная пирамида | [MnCl5]3- [Ni(CN)5]3- | |
| sp3d2, d2sp3 | октаэдр | [Al(H2O)6]3+ [SnCl6]2- [Co(NH3)6]3+ [Fe(CN)6]2- | |
| sp3d3 | пентагональная бипирамида | [V(CN)7]4- [ZrF7]3- |
Например, катион [Zn(NH3)4]2+ включает комплексообразователь цинк(II).
Электронная оболочка этого условного иона имеет формулу [Ar] 3d10 4s0 4p0 и может быть условно изображена так:
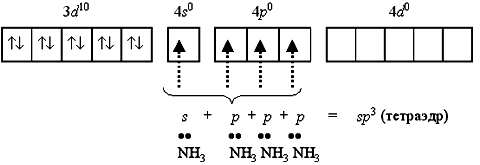
Вакантные 4s- и 4p-орбитали атома цинка(II) образуют четыре sp3-гибридные орбитали, ориентированные к вершинам тетраэдра.
Каждая молекула аммиака имеет неподеленную пару электронов у атома азота. Орбитали атомов азота, содержащие неподеленные пары электронов, перекрываются с sp3-гибридными орбиталями цинка(II), образуя тетраэдрический комплексный катион тетраамминцинка(II) [Zn(NH3)4]2+:
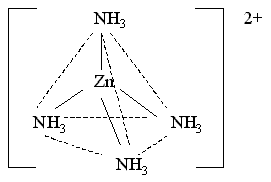
Поскольку в ионе [Zn(NH3)4]2+ нет неспаренных электронов, то он проявляет диамагнитные свойства.
Тетрахлороманганат(II)-ион [MnCl4]-2 содержит пять неспаренных электронов на 3d-орбитали и вакантные 4s- и 4p-орбитали. Вакантные орбитали образуют sp3-гибридные орбитали, которые перекрываются с p-атомными орбиталями хлорид ионов:
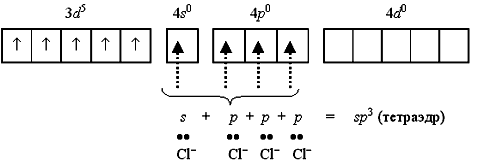
Полученный таким образом тетраэдрический ион [MnCl4]2 является парамагнитным, так как содержит пять неспаренных электронов.
Дата добавления: 2021-03-18; просмотров: 538;











