Характеристика состояния электронов в атоме квантовыми числами
а) Главное квантовое число (n) определяет общую энергию электрона на данном уровне, или средний радиус электронного облака. Оно принимает натуральные значения от 1 до ∞ (до бесконечности). В реальных атомах n имеет 7 значений, обозначаемых латинскими буквами K, L, M, N, O, P, Q. Значение n=1 отвечает уровню с самой низкой энергией (т.е. наиболее устойчивому состоянию электрона). Теоретически количество уровней не ограничено, но в атоме главным образом бывают заняты электронами уровни с низкой энергией (Рис.4.2.).

Рис.4.2. Диаграмма уровней энергии атома водорода (кДж/моль)
б) Побочное, или орбитальное, квантовое число (ℓ).
В атоме водорода имеется один электрон и энергия электрона зависит только от значения главного квантового числа и состояния по всем остальным квантовым числам являются вырожденными (с одинаковой энергией, рис.4.2.).
В спектрах многоэлектронных атомов наблюдается мультиплетная структура линий, т.е. линии расщеплены на несколько компонент. Мультиплетность линий означает, что энергетические уровни представляют собой совокупности энергетических подуровней, т.к. любой линии в спектре отвечает переход электрона из одного состояния в другое. Энергетические различия в состоянии электронов в данном уровне связаны с различием в форме электронных облаков. В многоэлектронном атоме из-за межэлектронного взаимодействия, величина которого определяется формой электронного облака, а значит орбитальным квантовым числом, наблюдается зависимость энергии электрона на данной орбитали от величины как n так и ℓ, хотя зависимость энергии электрона от величины n больше, чем от значения ℓ (Рис.4.3.). Вырожденными состояния электронов являются по магнитному и спиновому квантовым числам, т.е. энергия электронов, характеризующихся одинаковыми главным и побочным квантовыми числами, одинакова. Эти электроны находятся на одном энергетическом подуровне.

Рис.4.3. Энергетическая диаграмма уровней с 1-го по 3-й многоэлектронного атома
Для характеристики энергетических подуровней используется орбитальное квантовое число ℓ. Оно может принимать в пределах каждого уровня целочисленные значения от 0 до n–1. Таким образом, уровень в зависимости от ℓ подразделяется на подуровни, которые имеют также буквенные обозначения: s (ℓ = 0), p (ℓ = 1), d (ℓ = 2), f (ℓ = 3). Электроны, находящиеся в этих состояниях, называются s-, p-, d- и f-электронами.
Форма s-электронного облака. Это облако обладает сферической симметрией (значения Y равны для всех точек, находящихся на одинаковом расстоянии от ядра атома), т.е. имеет форму шара (Рис. 4.4. Б). График волновой функции находится по одну сторону оси абсцисс (Рис. 4.4. А), т.е. волновая функция s-электрона положительна, причем, значение волновой функции s-электронов отлично от нуля в начале координат (ядро атома, r = 0, Y ≠ 0).
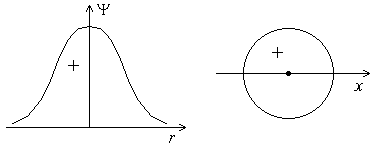
А Б
Рис. 4.4. График волновой функции s-электрона в зависимости от расстояния до ядра (А). Форма s-орбитали (Б)
Форма p-электронного облака. Для p-электрона при удалении от ядра по некоторому направлению волновая функция имеет перегиб. По одну сторону от ядра Y положительна, а по другую – отрицательна. В начале координат Y обращается в нуль (r = 0, Y = 0). В отличие от s-орбитали, электронное облако p-орбитали не обладает сферической симметрией, а имеет форму, напоминающую гантель (Рис.4.5.). Знаки «+» и «–» относятся не к вероятности нахождения электрона (она всегда положительна и равна |Y|2), а к волновой функции, которая в разных частях электронного облака имеет различный знак.
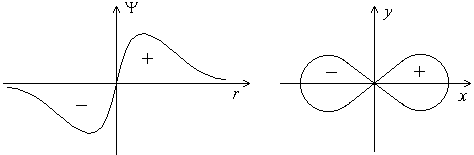
Рис. 4.5. График волновой функции p-электрона. Форма p-электронного облака
Еще более сложную форму имеют электронные облака d- и f-электронов. Например, d-орбитали могут иметь четырехлепестковое строение, причем знаки волновой функции в «лепестках» чередуются (Рис.4.6.).
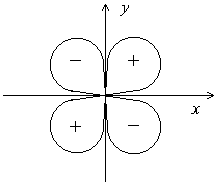
Рис.4.6. Форма d-электронного облака
в) Магнитное квантовое число (ml). Если атом поместить во внешнее магнитное поле, то происходит дальнейшее расщепление спектральных линий. Это означает, что при данных значениях n и ℓ может существовать несколько состояний электрона с одинаковой энергией. Такие энергетические состояния называются вырожденными. Вырождение исчезает при воздействии на атом внешнего магнитного поля, что и приводит к появлению новых линий в спектре.
Энергетические изменения под действием магнитного поля объясняются различием в характере расположения электронных облаков в пространстве и, следовательно, их различной ориентацией по отношению к силовым линиям поля. Магнитное квантовое число mℓ для данного подуровня – это целочисленная величина в диапазоне от –l до +l. Таким образом, при данном ℓ оно имеет (2ℓ+1) различных значений. Например, для s-подуровня (ℓ = 0) имеется только одно значение mℓ, равное нулю. Поэтому s-подуровень содержит единственную орбиталь. Для p-подуровня (ℓ = 1) возможны три значения: mℓ{–1,0,1}.
Атомная орбиталь (АО) – это состояние электрона в атоме, характеризуемое определенным значением главного, орбитального и магнитного квантовых чисел. В соответствии с этим каждый p-подуровень состоит из трех орбиталей гантелеобразной формы, ориентированных перпендикулярно друг другу вдоль трех координатных осей и обозначаемых px, py, pz. Легко определить, что на d-подуровне (ℓ = 2) содержится 2ℓ+1=5 орбиталей, а на f-подуровне (ℓ = 3) – 7 орбиталей.
г) Спиновое квантовое число (ms) не связано с движением электрона вокруг ядра, а определяет его собственное состояние. Природа этого состояния неизвестна до сих пор. Предполагается, что она связана с вращением электрона вокруг собственной оси"Spin" в переводе с английского – «кружение», «верчение». Число ms принимает два значения: +1/2 и –1/2.
Спин-орбиталь – это состояние электрона в атоме, характеризуемое определенным значением главного, орбитального, магнитного и спинового квантовых чисел.
На рисунке 4.7. показано постепенное усложнение представлений о структуре электронной оболочки атома (от уровней к подуровням и далее к орбиталям).
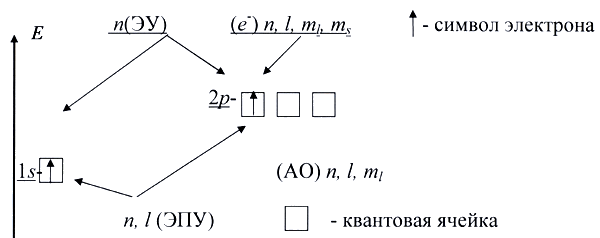
Рис.4.7. Эволюция представлений о строении электронной оболочки атома.
Условные обозначения, применяемые в квантовой химии: ЭУ электронный уровень (характеризуется определенным значением главного квантового числа), ЭПУ – электронный подуровень(характеризуется определенным значением главного и орбитального квантовых чисел), АО – атомная орбиталь (квантовая ячейка), которую принято изображать клеткой (характеризуется определенным значением главного, орбитального и магнитного квантовых чисел). Электроны на орбиталях изображены стрелками ↑↓, направленными вверх или вниз в зависимости от знака спинового квантового числа. Изображение электронной структуры атома или иона с помощью клеток и стрелок называется электронно-графической формулой.
Дата добавления: 2021-03-18; просмотров: 741;











