Общая характеристика и классификация противогрибковых средств (ПГС).
Противогрибковые средства – группа ЛС, используемая для лечения микозов - заболеваний, вызываемых патогенными грибами. Грибы – эукариотические организмы, сочетающие в себе признаки растений и животных: 1. имеют клеточную стенку как растения (но содер. хинин, как животные) 2.неподвижны (как раст), 3. Гетеротрофный тип питания (животн.), запасают гликоген, синтезируют мочевину.
Классификация ПГС.: По применению: * для местного прим.; * для системного прим. По Хим. строению:1. Азолы; 2. Аллиламины; 3. Противогрибковые
 антибиотики (гризеофульвин, антибиотики); 4. Эхинокандины; 5. ЛС др. структуры (фенолы, нуклеозиды и др.)
антибиотики (гризеофульвин, антибиотики); 4. Эхинокандины; 5. ЛС др. структуры (фенолы, нуклеозиды и др.)
| Клотримазол | Азолы- группа ПГС, в молекулах кот. содержатся остатки имидазола или 1,2,4- триазола. Ингиб. цитохром Р450-зависимые ферменты, учавствующие в синтезе эргостерина – компонента клеточной мембраны грибов. Для местного применения: Клотримазол, Кетоконазол, Миконазол. Для системного применения: Кетоконазол, Флуконазол, Вориконазол, Интраконазол |
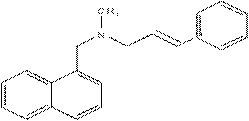 Нафтифин
Нафтифин
| Аллиламины– группа ПГС, являющихся производными метил(1- нафтилметил)аллиламина. Ингибируют процесс синтеза эргостерина. В результате уменьшения содержания эргостеринаизменяются свойства и нарушаются функции КМ. Нафтифин, Тербинафин, |
 Гризеофульвин
Гризеофульвин
| Противогрибковые антибиотики. Гризеофульвин и антибиотики. Производное бензофурана. Активен только (+)- энантиомер. Действует только на активно растущие грибы. Обладает фунгистатической активностью в отношении различных дерматофитов (Microsporum sp., Trichophyton sp.и др. Не действует на дрожжевые грибы |
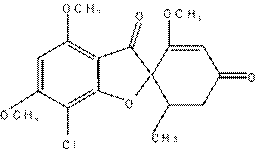
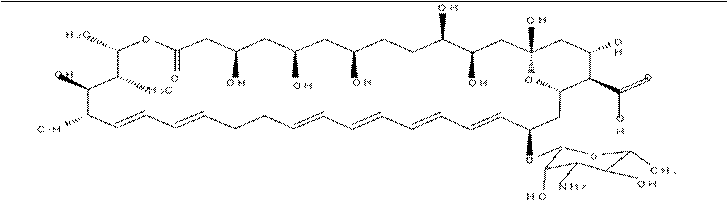
| Полиеновые антибиотики– группа АБ гликозидной природы, основу которыхтсоставляет макроциклическое лактонноекольцо, содержащее систему сопряжённых двойных связей. По числу атомов в лактонном цикле различают: 26-членные (Натамицин) и 38-членные (Нистатин и Амфотерицин В) |
 |
72.Общ. х-ка и класиф. п/опухолев. ср-в:
-это лек-ва, к. используются для лечения злокач. опухолей. Класиф.:
1.Алкилирующие ср-ва:
а)хлорэтиламины (мелфалан, циклофосфамид), б)этиленимины (тиофосфамид),
в)металлоорганические соединения платины (цисплатин, карбопластин), г)производн. нитрозомочевины (ломустин)
2. В-ва растительн. происх.:
а)алкалоиды барвинка розового (винбластин, винкристин), б)алкалоиды безвременника великолепного (колхамин), в)терпеноиды тисового дерева (паклитаксел, доцетаксел)
3. Антибиотики:
а)антрациклины (доксорубицин,) б)актиномицины (дактономицин) в)гликопептиды (блеомицин)
4.Ферментные препараты:(аспарагиназа) 5.Антагонисты гормонов:
а)а/эстрогены- тамоксифена цитрат,
б)а/андрогены (ципротерона ацетат, флутамид).
№1.-за счет алкильных радикалов ковалентно связываются (алкилируют) с ДНК→ нарушен. ее матричных функций в п-се репликации и транскрипции.
Алкилируются и др. макромолекулы → цитотоксич. эффект и гибель
опухолев. клеток. Эти в-ва циклонеспецифичны (способны повреждать в различн. фазы клеточного цикла, особенно быстро делящиеся клетки)
Избирательность низкая→высокотоксичны, ↓ кроветворение,↓ наруш. гаметогенез, выз. тошноту, рвоту, поврежд. слизистые.
иммунитет,
№2.-наруш. сборку и вызыв. разрушение митотического веретена → препятств. расхождению хромосом к полюсам клетки → остановка митоза в метафазе→гибель клеток.
№3.-Наруш. ф-ции ДНК, индуцир. образов. в клетках свободных радикалов
кислорода → цитотоксич. эффект на опухолев. и здоровые
быстропролифелирующие ткани.
№5.Тамоксифен-агонист рецепторов к эстрогенам
→ связывается с
рецепторами → препятствует взаимодейств. с ними эстрогенов → блокирует их
влияние на органы и ткани-мишени, в т.ч. опухолевую →
эстрогензависимых опухолей.
тормож. роста
Ципотерон-блок связыв. дигидротестостерона с специфич. рецепторами в клетках-мишенях,+выраженное гестагенное д-е = тормозит гонадотропную ф-
цию гипофиза → ↓
тестостерон.
→ огранич. стимулирующего д-я эндогенных
андрогенов на пролиферацию клеток.
№4.-разрушает (дезаминирует) в сыворотке крови аспарагин, ↓его содержание в крови и поступление в клетки →наруш. синтез белков в опух. клетке, не способной синтезировать аспарагин из-за дефицита аспарагинсинтетазы → остановка деления опухолев. тканей.
73.Общая хар-ка и классиф.противоопух.,относ.к антиметаболитамПротивоопух.=Лс, исп.для леч-я опухолей.

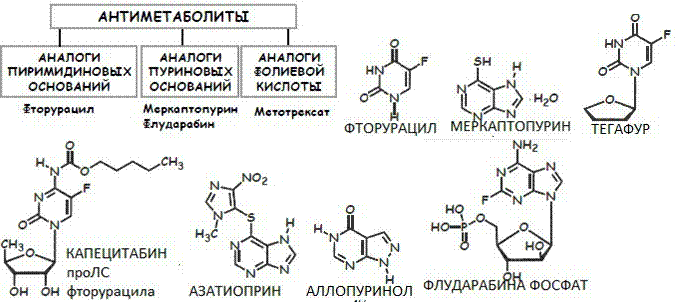
 Фторурацил включается в РНК вместо УТФ и наруш.с-з тимидилата предшественника.
Фторурацил включается в РНК вместо УТФ и наруш.с-з тимидилата предшественника.
Имеет про ЛС=тегафур и капецитабин.
Азатиоприн=обладает иммунносупрес. Дей
-ем
Аллопуринол=ингиб-р ксантиноксидазы, оказ. гипоурикимич.дей-е
.превращ. в активный метаболит
Флударабин = фосфат спрособ-ет повыш-ю растворим. И про ЛС. Ингиб.с-з ДНК
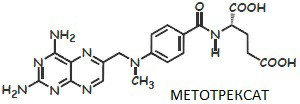
Метотрексат=аналог фолиевой к-ты, инг. Дигидрофолатредуктазу.
75. Общая хар-ка и класс-ция радиофармацевтических ЛС (РФЛС). Терминология.
РФЛС –ЛС, содержащие в готовом для применения состоянии 1 и > радионуклидов.
Нуклид –опред. вид атомов, хар-щийся опред-ым массовым числом, атомным номером и энергетическим состоянием ядер и имеющий время жизни, достаточное для наблюдения.
Изотопы– нуклиды, имеющие одинаковый порядковый номер, но при этом разные массовые числа. Радионуклид– нуклид, это определенный вид атома, ядро которого не стабильно и испытывает радиоактивный распад. Ядерно физические хар-ки радионуклидов: период полураспада (бывают нуклиды долгоживущие, среднеживущие, короткоживущие, ультракороткоживущие); вид излучения; энергия излучения, МэВ; опасность при внешнем облучении/ внутреннем облучении. Типы радиоактивного распада: 1) Изомерный переход – ядро переходит с более высокого на более низкий энергетический уровень с выделением γ-излучения; 2) Электронный захват – ядро захватывает е-, кот. взаимод. с протоном с образованием нейтрона; 3) Бета-минус распад – это РА распад, сопровождающийся испусканием из ядра электрона и электронного
 антинейтрино; 4) Позитронный распад - ядро испускает позитрон и электронное нейтрино (это явление исп .в позитронно-эмиссионной томографии); 5) Альфа распад -самопроизвольный распад атомного ядра на дочернее ядро и α-частицу (ядро атома 4Hе).
антинейтрино; 4) Позитронный распад - ядро испускает позитрон и электронное нейтрино (это явление исп .в позитронно-эмиссионной томографии); 5) Альфа распад -самопроизвольный распад атомного ядра на дочернее ядро и α-частицу (ядро атома 4Hе).
Классифицируют РФЛС по назначенияю: диагностические РФЛС, терапевтическиеe РФЛС.
РФЛС диагностического назначения – содержат γ – или β+ -излучающий радионуклид, являющийся информационным носителем , излучение которого, проникающее за пределы организма, регистрируется внешними детекторами. В РФЛС терапевтического назначения радионуклид (β-, α- излучатель, радионуклид, распад которого сопровождается электронным захватом или внутренней конверсией электронов) позволяет локализовать лечебную дозу излучения непосредственно в органе-мишени и обеспечить минимальное облучение здоровых органов и тканей.
Хим. природа РФЛС: простые в-ва, хилаты, неорганические соли, меченные октаном вещества, в т.ч. биополимеры.
Тропность к различным тканям и органам: органопропные (ЦНС, кардио-, гепато-, нефро-, остеотропные); туморотропные (опухолевые ткани).
РФЛС в АТХ
V09 Диагностические РФЛС / V10 Радиотерапевтические РФЛС V09A РФЛС для исследования ЦНС
V09AA Соединения технеция (99 m Tc) V09AA01Технеций (99 m Tc) экстаметазим V09AВ Соединения йода (123m I)
V09AВ01Иофетамин (123m I)
V09AХ Диагностические РФЛЗ для ЦНС и др. V09AХ01Индий (111In) пентетат
V09В РФЛС для исследования скелета
V09ВА Соединения технеция (99 m Tc) V09AA03Технеция (99 m Tc) пирофосфат
V09C РФЛС для выявления заболеваний почек V09CA Технеций 99-m-содержащие препараты V09CA01Технеций 99m пентетат
V09CX РФЛС для выявления заболевания почек др. V09CX01Йод-123 гиппурат
V09CX02Йод-131 гиппурат
V09Е РФЛС для выявления заболеваний дыхательной системы V09ЕА Соед. технеция (99 m Tc) для инголяций
V09ЕА01Технеция (99 m Tc) пентеат
V09ЕВ Соед. технеция (99 m Tc), частицы для иньекций V09ЕВ02Технеций (99 m Tc), микросферы
V09ЕХ РФЛС для исслед ДС другие
V09ЕХ01Криптон (81m Kr), газ
V09F РФЛС для диагностики заболеваний щитовидной железы V09FХ РФЛС для исслед ЩЖ др.
V09FХ02Натрия йодид (123 I)
V09H РФЛС для диагностики воспаления V09HА Соед. технеция (99 m Tc)
V09HА01Человеческий иммуноглобулин
V09HВ Соед. Индия (111In)
V09HА01Клетки, мишени индия (111In) оксинатом V09HХ РФЛС для диагностики восп и инф.
V09HА0
V09I РФЛС для диагностики новообразований V09IА Соед. технеция (99 m Tc)
V09IА01Технеций (99 m Tc) Антикарциноэмбриоантиген антителоV09IB Соед. Индия (111In)
V09IB02Индий (111In) пентереотид
V09IX РФЛС для диагностики опухолей др. V09IX01Иобенгуан
V09X РФЛС диагностические другие V09XА Соединения йода (131m I) V09XА01Йод (131m I) норхолестерин
V09XХ Различные диагностические РФЛС
V09XХ01Кобальт (57Со)цианокобаламин V10A Противовосполительные ср-ва V10AA Соед. Иттрия (90Y)
V10AA01Иттрия (90Y) цитрат коллоидный V10AХ противовосполительные РТР др.
V10AХ06Золото (198Au) коллоидное
V10 B РТС для полиативного устранения боли V10 BХ Различные РТС для ПЛ КМ
V10 АХ01Стронция (89 Sr) хлорид V10X РТС другие
V10XА Соед. йода
V10XА01 Натрия йоодит (131I)
131. Полусинтетические пенициллины: оксациллин, ампициллин, амоксициллин. Химическое строение. Связь структуры и действия.
Пенициллины (пенамы)– бета-лактамные АБ,
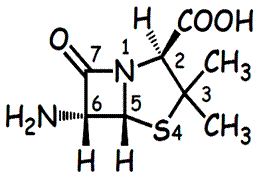 являющиеся производными 6- аминопинициллановой к-ты (см. рисунок). Относятся к β-лактамным АБ. У полусинтетических пенициллинов через аминогруппу связаны ароматические или гетероциклические радикалы.
являющиеся производными 6- аминопинициллановой к-ты (см. рисунок). Относятся к β-лактамным АБ. У полусинтетических пенициллинов через аминогруппу связаны ароматические или гетероциклические радикалы.
Изоксазолпенициллины (оксациллин); Аминопенициллины (ампициллин,
амоксициллин);
Карбоксипенициллины (карбенициллин); Уреидопенициллины (пиперациллин).
Амидинопенициллины (мециллинам).
Поколения пенициллинов: первое (природные, Гр+), второе (оксациллин, Гр +), третье (амоксициллин, ампициллин,Гр+,Гр-), четвертое (уреидопенициллины, высокоэффект. в отношении синегнойной палочки).
Связь структуры и д-я.6-аминопенициллиновую к-ту можно рассматривать
как дипептид из ЦИС и СЕР или ЦИС и ВАЛ. В мол-ле 3 центра хиральности (у атома 2, 5, 6). Атом С5 обязательно R.
Положение С2.Удаление или модификация СООН резко снижает
антибактериальную активность. Сложные эфиры м.б. в качестве пролекарства, т.к. не обладают фармакологической активностью но хорошо всасываются в кровь из ЖКТ, где затем гидролизуются (напр. бакампициллин).
Положение С3.Удаление метильных групп снижает активность в отношении
Гр + и не влияет на активность в отношении Гр-. Образование ацетоксиметильных производных значительно уменьшает антибактериальную активность.
Положение S4. Образов. сульфоксидов ↓ u#6ʀ6# 6 6Au ʖ 6#6ʁu #A.
Диоксиды являются необратимыми ингибиторами β-лактамаз.
Положение С5.Любыемодификации→ # # u#6ʀ6# 6 6Au активности, т.к. происходит увеличение прочности амидной связи в β- лактамном кольце→ # 6ʏ 66 k kʗ# #ʁ6ʗ ʁŒ 6a ʃ #ʁ6ʖ a 66 6ʓ пенициллина с пенициллин-связующим белком (ПСБ).
Положение С6.Модификация приводит к образованию полусинтетических
пенициллинов.
Карбоксипенициллины и изоксазолпенициллины более устойчивы к д-ю β- лактамаз, т.к. их конкурентные ингибиторы. Аминопенициллины – облад. повышенной кислотоустойчивостью и могут применятся перорально. Амидинопенициллины д-ют на Гр- кишечной группы.
Мех-м д-я: являются гидрофильными. Проникают в клетки бактерий через
пориновые каналы внешней мембраны и связываются с ПСБ (благодаря сродству с активным центром ПСБ) на внутренней мембране бактериальной кл. ПСБ – транспептидаза, катализирующая конечную стадию образования пептидогликана (основного компонента клеточной стенки бактерий). Происходит раскрытие β-лактамного кольца→ 6u%6ʀ6 ʁ u6 ł .
132 Цефалоспорины (цефемы): цефазолин натрия, цефалексин, цефаклор, цефоперазон натрия, цефотаксим натрия, цефуроксим натрия, цефуроксим аксетил, цефтриаксон натрия, цефтазидим. Химическое строение. Связь структуры и действия.
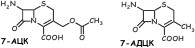 Цефалоспорины (цефемы)- антибиотики, являющиеся производными 7-аминоцефалоспорановой или 7- аминодезацетоксицефалоспорановой кислоты.
Цефалоспорины (цефемы)- антибиотики, являющиеся производными 7-аминоцефалоспорановой или 7- аминодезацетоксицефалоспорановой кислоты.
Классификация Цефалоспорин по поколениям:
Первого поколения (Цефалексин, Цефазолин): активны в отношении Гр+ кокков (кроме энтерококков), в том числе и образующих БЛ. Разрушаются БЛ Гр- бактерий.
Второго поколения (Цефуроксим, Цефаклор): действуют не только на Гр+ кокки,
но и некоторые Гр- микроорганизмы.
Третье поколение (Цефотаксим, Цефтазидим, Цефтриаксон): более активны, чем ЦС I и II вотношении Гр-. Стафилококк и другие кокки к ним менее чувствительны. Четвертое поколение (Цефепим): Менее активны в отношении Гр+, чем ЦС I, и не превышают по активности действие ЦС III на Гр-, но более устойчивы к действию БЛ и высокоэффективны в отношении анаэробов.
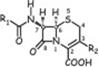 Связь структуры действия.В основе полусинтетических ЦС лежит структура 7- АЦК или 7-АДЦК. Биологической активностью обладают соединения, укоторых 6-й и 7-й атомы в остатке 7-АЦК (7-АДЦК) имеют R- конфигурацию. Антибиотики, у которых в 7-м положении содержится метоксигруппа, имеют S-конфигурацию данного атома).
Связь структуры действия.В основе полусинтетических ЦС лежит структура 7- АЦК или 7-АДЦК. Биологической активностью обладают соединения, укоторых 6-й и 7-й атомы в остатке 7-АЦК (7-АДЦК) имеют R- конфигурацию. Антибиотики, у которых в 7-м положении содержится метоксигруппа, имеют S-конфигурацию данного атома).
Положение С2. При замещении карбоксильной группы на сложноэфирную получают цефалоспорины-пролекарства, применяемые перорально. Они хорошо всасываются в ЖКТ и затем в плазме гидролизуются неспецифическими эстеразами с образованием активного антибиотика (Пример Цефуроксим аксетил).
Положение С3. Заместитель оказывает существенное влияние на фармакокинетические свойства цефалоспоринов. В качестве заместителей обычно используют азот и серусодержащие гетероциклические с-мы. Введение заместителей с четвертичным аммониевым азотом приводит к увеличению антибактериальной активности соединения (особенно в отношении Гр-) (Пр. Цефтазидим).
ПоложениеС4Введение алкоксигрупп уменьшает АБ активность, причём тем сильнее, чем больше атомов С содержится в алкоксильном остатке
ПоложениеS5. Образование сульфоксидов уменьшает биологической активности, замена S на O или C повышает её (Пример, Лоракарбеф, Моксалактам).
Положение С6. Введение заместителей приводит к полной потере антибактериальных свойств.
Положение С7.Изменение N-ацильного заместителя – основной способ модификации фармакологических свойств ЦС и используется для получения полусинтетических цефалоспорин. Введение CH3O-(цефамицины) или N- формиламиногруппы повышает устойчивость в отношении БЛ (Цефокситин).
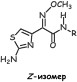 |
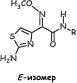 У иминоцефалоспоринов Z-изомеры (син-изомеры) более активны, чем E- изомеры (анти-изомеры).
У иминоцефалоспоринов Z-изомеры (син-изомеры) более активны, чем E- изомеры (анти-изомеры).
133. Карбапенемы: имипенем, меропенем. Монобактамы: азтреонам. Ингибиторы бета-лактамаз: калия клавуланат, сульбактам натрия. Химическое строение. Связь структуры и действия.
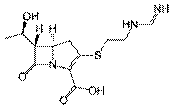 Имипенемразрушается дигидропептидазой почек I типа с образованием токсичных продуктов. Применяют только совместно с циластатином – ингибитором фермента, разрушающего имипенем (ЛС, содержащее имипенем и натриевую соль циластатина называется «Тиенам»).
Имипенемразрушается дигидропептидазой почек I типа с образованием токсичных продуктов. Применяют только совместно с циластатином – ингибитором фермента, разрушающего имипенем (ЛС, содержащее имипенем и натриевую соль циластатина называется «Тиенам»).
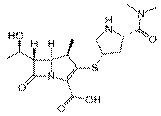 Меропенемне разрушается дигидропептидазой и более активен, чем имипенем, в отношении грамотрицательных микро-организмов. Легкость проникновения через клеточную стенку бактерий, высокий уровень стабильности практически ко всем β
Меропенемне разрушается дигидропептидазой и более активен, чем имипенем, в отношении грамотрицательных микро-организмов. Легкость проникновения через клеточную стенку бактерий, высокий уровень стабильности практически ко всем β
-лактамазам и значительная аффинность к белкам, связывающим
 пенициллин, обусловливают мощное бактерицидное действие меропенема против широкого спектра аэробных и анаэробных бактерий. Влияние на активность: С(3)− модификация молекулы в данном положении может приводить к повышению устойчивости к действию кислот и лактамаз. Введение амидиновой группы в 2-тиоэтильный фрагмент карбапенема повышает активность в отношении грамотрицательных микроорганизмов. С(4)− введение метильной группы приводит к увеличению устойчивости к действию дигидропептидаз почек. С(6)− даже при отсутствии заместителя в данном положении антибактериальное действие в-ва сохраняется. Максимальной антибактериальной активностью обладают карбапенемы, содержащие в 6-мположении 1R-гидроксиэтильную группу (защищает β-лактамное кольцо и обеспечивает устойчивость в отношении β-лактамаз). 6-ациламидные производныехим. нестабильны и биологически неактивны.
пенициллин, обусловливают мощное бактерицидное действие меропенема против широкого спектра аэробных и анаэробных бактерий. Влияние на активность: С(3)− модификация молекулы в данном положении может приводить к повышению устойчивости к действию кислот и лактамаз. Введение амидиновой группы в 2-тиоэтильный фрагмент карбапенема повышает активность в отношении грамотрицательных микроорганизмов. С(4)− введение метильной группы приводит к увеличению устойчивости к действию дигидропептидаз почек. С(6)− даже при отсутствии заместителя в данном положении антибактериальное действие в-ва сохраняется. Максимальной антибактериальной активностью обладают карбапенемы, содержащие в 6-мположении 1R-гидроксиэтильную группу (защищает β-лактамное кольцо и обеспечивает устойчивость в отношении β-лактамаз). 6-ациламидные производныехим. нестабильны и биологически неактивны.
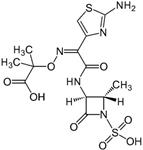
Азтреонам −антибиотик узкого спектра действия. Активен в отношении грамотрицательных микроорганизмов, обладает устойчивостью к β-лактамазам. Влияние на активность N(1)− в N-незамещённом монобактаме ациламидная связь слишком прочна, поэтому антибактериальная активность отсутствует. Основная роль электроноакцепторной группы (чаще всего –SO3H), находящейся при атоме азота, − ослабление ациламидной связи. С(2)− введение ме-
метильной или карбамоилоксиметильной группы увеличивает устойчивость по отношению к β-лактамазам, но с увеличением размера заместителя уменьшается антибактериальная активность. С(3)− должен иметь S- конфигурацию. Наиболее активны монобактамы, содержащие в 3-положении такой же N-ацильный фрагмент, что и цефалоспорины 3-го и 4-го поколений. Введение в 3-положение метокси- или N-формиламиногруппы повышает ус тойчивость по отношению к β-лактамазам.
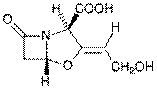 Клавулановая к-таявл-ся природным соединением (продуцент − Streptomyces clavuligerus). Антимикробная активность невелика, поэтому в качестве ЛВ не используется. Малотоксична, невысокая химиче ская
Клавулановая к-таявл-ся природным соединением (продуцент − Streptomyces clavuligerus). Антимикробная активность невелика, поэтому в качестве ЛВ не используется. Малотоксична, невысокая химиче ская
устойчивость. В состав ЛС входит в виде калиевой соли. Влияние на активность: С(2)− превращение карбоксильной группы в
сложно-эфирную (метиловый, бензиловый эфиры) или её удаление не изменяет биологической активности соединения. С(3)− при гидрировании двойной связи ингибирующая актив-ность уменьшается. Замена OH-группы в заместителе при С3 на амино-, дибензиламино-, фенил- группу приводит к значительному увеличению активности. O(4)− тиоаналог клавулановой кислоты обладает менее выраженными ингибирующими св-ми.
134. Аминогликозиды: стрептомицина сульфат, гентамицина сульфат, тобрамицин, амикацина сульфат. Химическое строение. Связь структуры и действия.
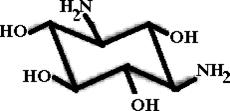 Аминогликозиды (аминоциклотолы)-антибиотики гликозидной природы, агликонами которых являются производные циклогексана, содержащие гидроксильные, амино- или гуанидиновые группы. Родоначальным веществом, лежащим в основе структуры агликона АГ, является D-стрептамин
Аминогликозиды (аминоциклотолы)-антибиотики гликозидной природы, агликонами которых являются производные циклогексана, содержащие гидроксильные, амино- или гуанидиновые группы. Родоначальным веществом, лежащим в основе структуры агликона АГ, является D-стрептамин
.При замещении аминогрупп на остатки гуанидина ((NH2)2-C=NH) образуется D-стрептидин -агликон стрептомицина, антибиотика, продуцируемого Streptomyces griseus.
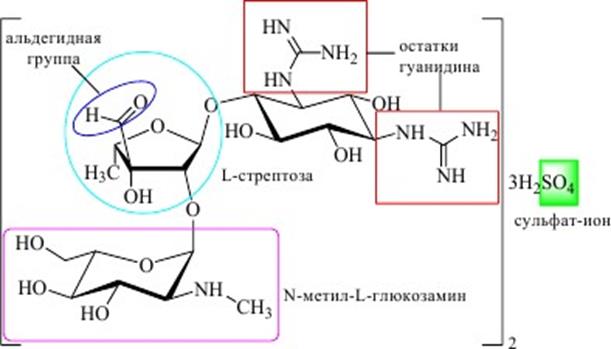 |
Химические свойства аминогликозидов обусловлены наличием гликозидных связей (кислотный гидролиз), углеводных остатков (дегидратация, приводящая к образованию замещённых фурфуролов), аминогрупп (основные свойства, взаимодействие с общеалкалоидными реактивами, нингидрином). Стрептомицин:
Остатки гуанидина обуславливают сильноосновные свойства стрептомицина. Величина pKBH+ гуанидина составляет 13,5; как основание он сравним с гидроксидами щелочных металлов. Стрептомицин является трёхкислотным основанием (две гунидиновые группы и вторичная аминогруппа в остатке N- метил-L-глюкозамина) и образует среднюю соль при взаимодействии с серной кислотой соотношении 2:3.
Гентамицин, тобрамицин, амикацин – 4,6 –замещенные 2-дезокси- D-
стрептамина.
Основной механизм устойчивости МО к АГ -ферментативная модификация молекул антибиотиков. Аминогликозидмодифицирующие ферменты: ацетилтрансферазы; фосфотрансферазы; аденилилтрансферазы. Получить аминогликозид, не подвергающийся инактивации бактериальными ферментами, невозможно. Можно лишь уменьшить число амино- и
гидроксильных групп, доступных для модификации. Ацильный остаток, присутствующий в молекуле амикацина, защищает от ацетилирования NH2- группу в 3-м положении в остатка 2-дезоксистрептамина и OH-группу во 2-м положении остатка 3-глюкозамина.
Гентамицин - смесь нескольких антибиотиков, продуцируемых
Micromonospora purpurea. У всех гентамицинов в 6-м положении циклогексанового кольца находится остаток гарозамина, а в 4-м положении – остаток пурпурозамина, содержащий различные радикалы при 6-м атоме углерода. Смесь гентаминцинов: гентамицин C1 (20–35%) и гентамицинС1a (10–30%). Лекарственным средством является гентамицина сульфат, который представляет собой смесь сульфатов различных гентамицинов.
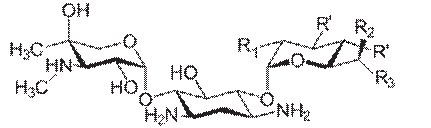
Тобрамицин – АГ антибиотик, синтезируемый Streptomyces tenebrarius. Имеет широкий спектр, в малых концентрациях действует бактериостатически. Связывается со специфическими белками-рецепторами на С рибосом – это нарушает образование инициирующего комплекса между матричной РНК и 30S СЕ рибосомы. В результате возникают дефекты при считывании информации с ДНК, синтезируются неполноценные белки, приостанавливается рост и развитие микробной клетки. В больших концентрациях нарушают проницаемость и барьерные функции цитоплазматической мембраны и поэтому обладают бактерицидным действием. 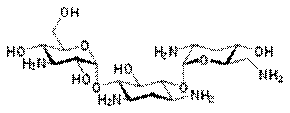
Амикацина сульфат: Широкого спектра действия (бактерицидно). Связываясь
с 30S субъединицей рибосом, препятствует образованию комплекса транспортной и матричной РНК, блокирует синтез белка, и разрушает цитоплазматические мембраны бактерий. Высокоактивен в отношении аэробных Гр- бактериями: Pseudomonas aeruginosa, Escherichia coli, Salmonella spp., некоторых Гр+ бактериями: Staphylococcus. Амикацин не активен в отношении анаэробных микроорганизмов
| Поколени е | Антибиотики | Особенности |
| Первое | Стрептамици н | Инактивируются 15 ферментами |
| Второе | Гентамицин | Более высокая активность к синегнойной палочке (СГП), инактивируются 10 микробными ферментами |
| Третье | Тобрамицин, Амикацин | Активны в отношении СГП, инактивируются 3-мя ферментами |
| Четверто е | Изепамицин | Более широкий спектр действия, инактивируются 3- мя ферментами |
АГ первого поколения из-за токсичности исп. только для лечения специфич.
инфекционных заболеваний. Остальные АГ - для лечения тяжелых системных инфекций, вызванных Гр- бактериями и стафилококками. АГ – сильно полярные вещества. Они практически не всасываются в ЖКТ, поэтому вводятся только парентерально. Транспортируются через мембраны путём активного транспорта, поэтому хорошо проникают в органы и ткани с интенсивным кровоснабжением. Способны накапливаться в тканях внутреннего уха и коркового слоя почек, поэтому обладают ото- и нефротоксичностью. Практически не подвергаются метаболизму. Выделяются почками в неизменённом виде.
135. Макролиды: эритромицин, кларитромицин, рокситромицин. Азалиды: азитромицин. Химическое строение. Связь структуры и действия.
Макролиды –антибиотики гликозидной природы, основу структуры агликонов которых составляет макроциклическое лактонное кольцо, состоящее из 14-16 атомов.
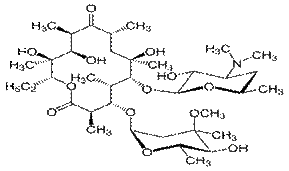
Эритромицин –группа макролидных антибиотиков, продуцируемых актиномицетом Saccaropolyspora erythraea.
Эритромицин А служит исходным веществом для получения ПСМ. Направления модификации молекулы:
- превращение OH-групп в OR,
- модификации 10-го или 3-его положений в структуре эртитронолида;
- получение кетолидов
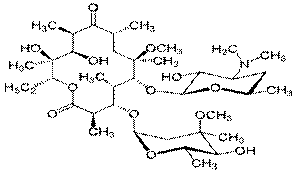
Кларитромицин –7-O-метилэритромицин А. По сравнению с эритромицином более устойчив в кислой среде, обладает лучшей фармакокинетикой и АБ действием.
Рокситромицин.
При модификации оксогруппы в 10-м положении эритронолида, вначале получается оксим, при превращениях образуются различные полусинтетические макролиды.
Рокситромицин – замещенный оксим эритромицина (эритромицин-10-(0-[2- метоксиэтокси] метил)оксим). По сравнению с эритромицином обладает лучшей фармакокинетикой, большей биодоступностью.
Азитромицин -имеет 15-членный лактонный цикл и относится к азалидам. Его можно рассматривать как гомолог эритромицина А, у которого карбонильная группа замещена метиламиногруппой. Лучше проникает в различные органы и ткани и более активен в отношении внутриклеточных МО.
Эритромицин Кларитромицин
 |  | ||
Дата добавления: 2021-03-18; просмотров: 731;











