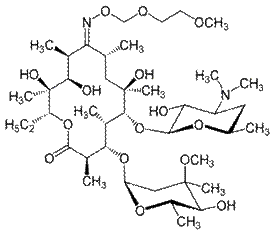
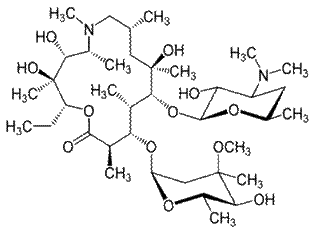
Рокситромицин Азитромицин
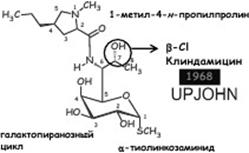
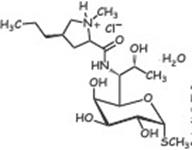
136. Линкозамиды: линкомицина гидрохлорид, клиндамицина гидрохлорид и фосфат. Химическое строение, связь структуры и действия.
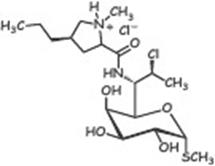
Линкозамиды (линкосамиды)–группа лекарственных средств, включающая природный антибиотик линкомицин (продуцент Streptomyces lincolensis) и полусинтетический – клиндамицин .
Описано более 500 природных антибиотиков группы линкозамидов. Узкий спектр действия (Гр+ кокки и неспорообразующие анаэробы). Действуют бактериостатически или бактерицидно, ингибируют синтез белка (50S)
| Клиндамицин | Линкомицина г/х | Клиндамицина г/х |
|
| 
|
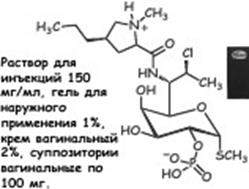
Клиндамицина фосфат
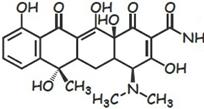
137.Тетрациклин и тетрац. HCl, доксициклина гиклат. Химич. строен. Связь стр-ры и ф-ции.
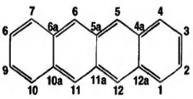
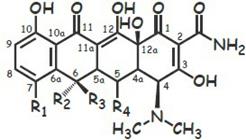 Основа хим. структуры-частично гидрированный цикл тетрацена (нафтацена)-ф-ла слева.
Основа хим. структуры-частично гидрированный цикл тетрацена (нафтацена)-ф-ла слева.
Есть природн.(тетрац.) и полусинтетич. (доксицикл.)
1,2,3, 4,10,11,11а,12-→ гидрофильн. часть молек.-ее менять нельзя-активн. ↓. Гидрофобн. частьменять можно:
1.Гидроксил при С5 не влияет на АМ активн, но влияет на фармакокинетику. 2.Сильно ЭА и ЭД заместители в С7 увелич-ют аткивность.
3. Заместитель при С6 важен для получ. полусинтетич. тетрац.:6-
дезокситетрац. >
х-ки.
устойч. в кислой и щел. среде, имеют лучшие фармакокинетич.
Гидрофильн. часть:
1.Замещение амидной группы на альдегидную или нитрильную ↓активн.
2.Моноалкилирование амидной группы ↓активн. пропорц. размеру алкила.
3.аминоалкилирование амидной группы приводит к образов. растворимых пролекарств.
4.Атом С4, связ. с диметиламиногруппой имеет S-конфигурацию.
Эпитетрациклины знач. < активны.
5.OH-группа в 12а важна для активности, ее превращ. в сложн. эфир устраняет активность.
6.Алкилирование при С11а →образ. неактивных соед.
7. Дегидрирование и образ. двойной связи м-ду С5а и С11а значит. ↓
активность.
 Бактериостатич. д-е у тетрац. Ингиб. синтез белка.
Бактериостатич. д-е у тетрац. Ингиб. синтез белка.
Проник. в ткани, м. откладываться(в компл. с Са2+) в костях, дентине, эмали.
Тетрациклин-таб.покрыт. обол. 100 мг., мазь глазная. Тетрациклина гидрохлорид – мазь 3% д/наружн. прим.
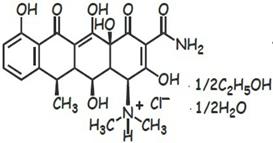 Доксициклина гиклат(вибрамицин, юнидокс солютаб)- капс., диспергируемые таб. по 100 мг, лиофилизат д/пригот. р-ра д/инфузий.
Доксициклина гиклат(вибрамицин, юнидокс солютаб)- капс., диспергируемые таб. по 100 мг, лиофилизат д/пригот. р-ра д/инфузий.
См. «гидрофобн.часть»-пункт 1 и 3.
 |
138.Амфениколы:хлорамфеникол и его эфиры.Хим.стр-е и Свять Струк. и дей-я
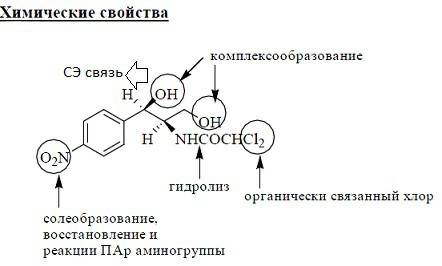
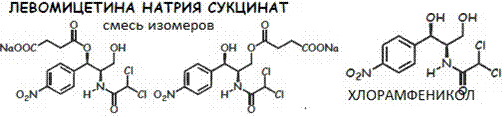 Амфениколы-группа АБ,относ.по хим.струк.к фенилалкиламинам. Хлорамфеникол=АБ широкого СД,
Амфениколы-группа АБ,относ.по хим.струк.к фенилалкиламинам. Хлорамфеникол=АБ широкого СД,
оказ.бактериостат.дей-е, инг с-з белков микроорг-ов. Очень горьк.вкуса, плохо р- м в воде.
Как ЛС исп.левомицетин, синтомицин(рацемат), сложн.эфиры стеариновой,пальмитиновой и янтарной(Na сукцинат)к-тами. СЭ связь образ.за счет связи с
–OH у 1ого атома С. СЭ корригируют горк.вкус,легко раст.в воде и исп. в виде РДИ.
Хлоармфеникол и его СЭ облад.оптич.акт-ю(S и R), поглощ.ЭМИ в УФ- диапазоне.
139. Сульфаниламиды: сульфаметоксазол, сульфадиазин серебра, сульфасалазин. Триметоприм и ко-тримоксазол. Химическое строение. Связь структуры и действия.
Сульфаниламиды (СА)− ЛВ противомикробного действия, являющиеся производными амида сульфаниловой кислоты (4-аминобензол сульфамида). Обладают широким спектром действия (как противомикробные ЛС системного действия практически не используются). Обладают бактериостатическим действием. Являются биоизостерами ПАБК. Ингибируют фермент дигидроптероатсинтазу у микроорганизмов.
 Химиотерапевтическая активность сульфаниламидных препаратов впервые была обнаружена в 1935 г. немецким врачом и исследователем Г. Домагком, который опубликовал данные об успешном применении в клинике прон-
Химиотерапевтическая активность сульфаниламидных препаратов впервые была обнаружена в 1935 г. немецким врачом и исследователем Г. Домагком, который опубликовал данные об успешном применении в клинике прон-
тозила (красного стрептоцида), синтезированного в качестве красителя. Вскоре было установлено, что «действующим началом» красного стрептоцида является образующийся при метаболизме сульфаниламид (стрептоцид).
На основе молекулы сульфаниламида было синтезировано большое количество производных. Синтез различных модификаций сульфаниламидов осуществлялся в направлении создания более эффективных, продолжительно действующих и менее токсичных препаратов.
Связь структуры и действия:У большинства СА один из атомов водорода в сульфамоильной группе замещён на гетероцикп, ацетил, остаток гуанидина или мочевины. Это повышает антимикробную активность (увеличивает кислотные свойства NH-кислотного центра). Замещение двух атомов водорода при атоме азота сульфамоильной группы приводит к образованию неактивных соединений. У некоторых СА заместители присутствуют как в сульфамоильной группе, так и в первичной ароматической аминогруппе. Второй заместитель является ацильным остатком дикарбоновой кислоты и используется для повышения гидрофильности соединения. Такие СА не всасываются в ЖКТ и используются для лечения микробных заболеваний ЖКТ. Азопроизводные СА являются двойными лекарствами и используются для лечения неспецифического язвенного колита и болезни Крона.
Длительность действия СА для системного применения зависит от их связывания с белками плазмы крови. Введение в остаток гетероцикла метоксигрупп увеличивает продолжительность действия.
Совместно с СА применяют триметоприм − ингибитор дигидрофолатредуктазы. Активность триметоприма в отношении ДФР Е.соli в 100000 раз выше, чем в отношении аналогичного фермента человека. Триметоприм вместе с сульфаметоксазолом (в соотношении 1:5) входит в состав Ко-тримоксазола. Сульфаметоксазол конкурентно замещает ПАБК и препятствует образованию дигидрофолиевой кислоты. Триметоприм блокирует следующий этап метаболизма фолиевой кислоты, нарушая образование тетрагидрофолиевой кислоты. Ко-тримоксазол оказывает бактерицидное действие.
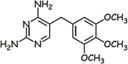
 сульфаметок сазол
сульфаметок сазол
 сульфадиазин серебра
сульфадиазин серебра
 сульфасалазин
сульфасалазин
Триметоприм
140.  Нитрофураны (НФ): нитрофурантоин, фуразолидон, нифурател, нифуроксазид. Химическое строение. Связь
Нитрофураны (НФ): нитрофурантоин, фуразолидон, нифурател, нифуроксазид. Химическое строение. Связь
Дата добавления: 2021-03-18; просмотров: 517;











