Энергия активации. Энергетический профиль реакции.
Реакции происходят в результате непосредственного столкновения молекул. Однако не все столкновения приводят к химическому взаимодействию. Образованию новых веществ способствуют только молекулы, обладающие достаточным запасом энергии. Такие молекулы называются активными молекулами.
Та минимальная энергия, достаточная для начала химической реакции называется энергией активации и выражается в ккал или кДж. Чем меньше энергия активации, тем быстрее идет реакция.
В реакциях, где энергия активации больше, чем 150 кДж при t=25°С скорость очень мала или практически эти реакции не протекают. В реакциях, где энергия активации меньше 60 кДж, скорость очень большая (взрыв).
Величина энергии активации Еа зависит от природы реагирующих элементов и служит характеристикой каждой реакции.
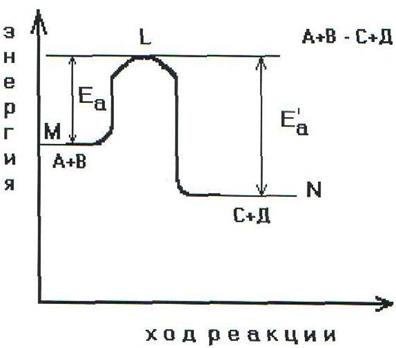 |
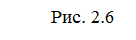
Энергетическая диаграмма хода реакции с образованием
активированного комплекса.
Чтобы реагирующие вещества А и В образовали продукты реакции С и Д они должны преодолеть энергетический барьер МL. На это затрачивается энергия активации Еа. При этом в ходе реакции из частиц реализующих веществ, образуется промежуточная неустойчивая группировка - активированный комплекс (рис.2.6).
Этот комплекс распадается с образованием конечных продуктов, причем выделяется такое количество энергии, которое позволяет конечным продуктам спуститься до уровня средней энергии конечных продуктов.
Т.о. изменение продуктов можно выразить в виде схем для эндотермической и экзотермической реакции (рис.2.7, 2.8).
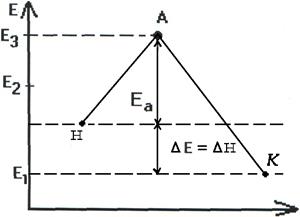
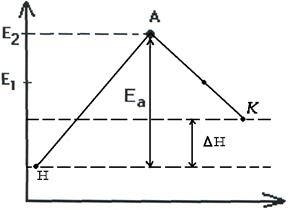

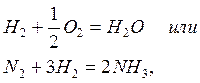 |
Обычно реакции между веществами с прочными ковалентными связями характеризуются большими значениями Еа и идут медленно. Это относится ко многим взаимодействиям, как
скорость которых при стандартных условиях равна 0.
 Малыми значениями Еа и очень большими скоростями характеризуются ионные взаимодействия в растворах
Малыми значениями Еа и очень большими скоростями характеризуются ионные взаимодействия в растворах
Катализ
Общие понятия.
Катализом называется ускорение скорости реакции в присутствии специфических веществ, количество которых в ходе реакции не изменяется.
Эти вещества только ускоряют скорость реакции, но не расходуются в результате ее протекании.
Катализаторы могут участвовать в образовании промежуточных продуктов реакции, но к концу взаимодействия полностью регенерируются.
Замедление реакций осуществляется при помощи ингибиторов(отрицательных катализаторов).
– При катализе не изменяется величина теплового эффекта реакции.
– Если катализируемая реакция обратима, катализатор не влияет на равновесие, не меняет Кр и равновесных концентраций компонентов системы. Он в равной степени ускоряет прямую и обратную реакцию.
– Катализаторы действуют избирательно, селективно.
Катализатор, активно ускоряющий одно взаимодействие, безразличен к другому.
Из одних и тех же веществ можно получить различные продукты, применяя разные катализаторы.

Некоторые вещества снижают или полностью уничтожают активность катализатора их называют каталитическими ядами – соединения мышьяка, свинца, цианида.
Добавки, увеличивающие активность катализатора называют промоторами.
Активность, селективность и срок службы катализатора во многом зависит от температуры каталитической реакции.
Существуют катализаторы, не обладающие специфичностью, их называют универсальными. К ним относятся металлические Nl, Pt, палладий, которые катализируют процессы гидрирования, окисления. Многие процессы являются автокаталитическими. В этих реакциях катализатором служит один из продуктов.
.
Цепные реакции
Под цепными реакциями понимают такие химические реакции, в которых появление промежуточно-активной частицы вызывает большое число (цепь) превращений исходныхмолекул.
В качестве активной частицы выступают свободные атомы, возбужденные молекулы –радикалы – частицы, имеющие один неспаренный электрон.
Большую роль в создании учения цепных реакций сыграли работы
Н. Н. Семенова и С. Хиншельвуда, которые за исследования в этой области получили Нобелевскую премию (1956 г).
Цепные реакции составляют основу многих практически важных процессов (крекинга, полимеризации, сгорания топлива и т. п.).
Различают 3 типа цепных реакций:
1. С неразветвленными цепями
2. С разветвленными цепями
3. С вырожденно-разветвленными
Каждый тип реакций включает 3 этапа - зарождение цепей, их развитие и обрыв.
Химические процессы с неразветвленными цепями можно рассмотреть на примере взаимодействия между водородом и хлором:
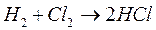
Подумайте, какая молекула - водорода или хлора - может распасться на атомы. Энергия связи молекулы водорода равна 436 кДж/моль, хлора 243. Конечно, будет происходить распад молекулы хлора.
Если смесь  и
и  храниться в темноте, то указанная реакция при обычных температурах не протекает. Для бурного течения этой реакции достаточно ввести в смесь ничтожное количество паров металлического натрия.
храниться в темноте, то указанная реакция при обычных температурах не протекает. Для бурного течения этой реакции достаточно ввести в смесь ничтожное количество паров металлического натрия.
Схему реакции по этапам можно записать так:
а) 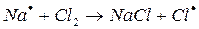 зарождение цепи
зарождение цепи

 б)
б) 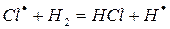
в) 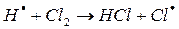
г) 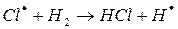

 д)
д) 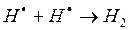
е) 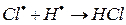
ж) 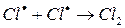
На первом этапе в реакциях зарождения цепей (а) образуется активная частица – свободный радикал или атом (С1). Большая скорость цепных реакций объясняется высокой реакционной способностью активных частиц.
На втором этапе развития реакций (б-г) активная частица реагирует с молекулой исходного вещества с образованием молекулы продукта с новой активной частицей. Регенерированная новая частица снова реагирует с молекулой и т. д. Таким образом, образуется неразветвленная цепь с
большим числом звеньев.
Энергия активации взаимодействия радикалов или атомов с молекулами не превышает 40 кдж/моль. Длина цепи из элементарных химических реакций достигает 10 тысяч и сотен тысяч звеньев.
На третьем этапе происходит обрыв цепей (д-ж). Она происходит в результате соединения (рекомбинации) атомов в объеме реактора, захвата его стенкой с последующей рекомбинацией на стенки, образованием неактивного радикала при взаимодействии активных частиц с примесями (они играют роль ингибиторов).
Дата добавления: 2016-11-26; просмотров: 8724;











