Общие свойства растворов.
Растворы – это однофазные (гомогенные) системы, состоящие из двух и более компонентов (составных частей) и продуктов их взаимодействия.
В природе и в промышленности растворы имеют огромное значение. Растения усваивают питательные вещества в виде растворов. Усвоение пищи связано с переводом этих веществ в раствор. Все природные воды являются растворами. Важнейшие физиологические жидкости - кровь, лимфа и др. –
также растворы. Большинство химических реакций протекает в растворах.
Растворы могут существовать в любом из агрегатных состояний: газообразном, жидком или твердом. Например, морская вода - это водный раствор различных солей. Металлические сплавы - твердые растворы одних металлов в других. Итак, любой раствор состоит, как минимум, из двух индивидуальных веществ, одно из которых считают растворителем, а другое - растворенным веществом. Между тем, такое деление очень условно, а для веществ, смешивающихся в любых соотношениях (вода - ацетон, золото - серебро) лишено смысла.
Способность к образованию растворов выражена в различной степени у различных индивидуальных веществ. Одни вещества способны растворяться друг в друге неограниченно (вода и спирт), другие - лишь в ограниченных количествах (поваренная соль в воде).
Раствор, в котором данное вещество при данной температуре уже больше не растворяется, т.е. раствор, находящийся в равновесии с растворяемым веществом, называют насыщенным.
В насыщенном растворе при данной температуре содержится максимально возможное количество растворенного вещества.
Если раствор, насыщенный при нагревании, осторожно охладить до комнатной температуры (так, чтобы не выделялись кристаллы соли), то образуется пересыщенный раствор. Таким образом, пересыщенным называют раствор, в котором при данной температуре содержится большее количество растворенного вещества, чем в насыщенном растворе. Пересыщенный раствор нестабилен, и при изменении условий (например, энергичное встряхивание или внесение кристаллика соли - затравки для кристаллизации) образуется насыщенный раствор и кристаллы соли, содержащейся в избытке. Пересыщенные растворы образуют сахароза, 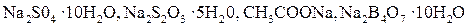 и др.
и др.
Малорастворимые и практически нерастворимые вещества часто
объединяют одним названием - малорастворимые. Тогда говорят только о
растворимых и малорастворимых веществах.
Растворимость
Количественно растворимость того или иного вещества выражается концентрацией насыщенного раствора.Чаще всего ее выражают при помощи массы вещества, которая может растворяться в 100 г воды при данной температуре, и иногда называют коэффициентом растворимостиили просто растворимостью вещества.Так, например, при 18° С в 100 г воды растворяется 51,7 г соли нитрата свинца (II) 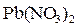 (т.е. растворимость этой соли при 18° С равна 51,7). Если при той же температуре сверх этой массы добавить еще соль нитрата свинца (II), то она не растворяется, а выпадает в виде осадка.
(т.е. растворимость этой соли при 18° С равна 51,7). Если при той же температуре сверх этой массы добавить еще соль нитрата свинца (II), то она не растворяется, а выпадает в виде осадка.
Говоря о растворимости вещества, следует указывать температуру при растворении. Чаще всего растворимость твердых веществ с увеличением температуры возрастает.
В отличие от большинства твердых тел растворимость газов в воде с повышением температуры уменьшается, что обусловлено непрочностью связи между молекулами растворенного газа и растворителя.
Другой важной закономерностью, описывающей растворимость газа в жидкостях, является закон Генри: растворимость газа прямо пропорциональна его давлению над жидкостью.
Эта закономерность выражается формулой:
x=kр,
где х - молярная доля растворенного вещества; р - давление; k - постоянная величина.
Следует отметить, что причины различной растворимости веществ до настоящего времени до конца не выяснены. Между тем, еще до обоснования теории растворов опытным путем было установлено правило, согласно которому подобное растворяется в подобном.Так, вещества с ионным типом связи (соли, щелочи) или полярным (спирты, альдегиды) хорошо растворимы в полярных растворителях, в первую очередь в воде. Например, метиловый, этиловый и пропиловый спирты смешиваются с водой в любых соотношениях. По мере дальнейшего увеличения углеводородного радикала в молекуле ROH происходит уменьшение полярности связи О-Н и растворимость спиртов в воде и воды в спиртах понижается. И наоборот, растворимость кислорода в бензоле на порядок выше, чем в воде, так как их молекулы ( 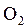 и
и 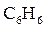 ) неполярны. Вместе с тем аммиак, молекулы которого полярны, намного лучше растворяется в воде, чем в неполярных органических растворителях.
) неполярны. Вместе с тем аммиак, молекулы которого полярны, намного лучше растворяется в воде, чем в неполярных органических растворителях.
Важной характеристикой любого раствора является его состав. Существуют различные способы численного выражения состава растворов: массовая доля растворенного вещества, молярная концентрация и др.
 Массовая доля растворенного вещества- это безразмерная физическая величина, равная отношению массы растворенного вещества к общей массе раствора, т.е.
Массовая доля растворенного вещества- это безразмерная физическая величина, равная отношению массы растворенного вещества к общей массе раствора, т.е.
где 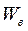 - массовая доля растворенного вещества;
- массовая доля растворенного вещества; 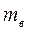 - масса растворенного вещества m - общая масса раствора.
- масса растворенного вещества m - общая масса раствора.
Массовую долю растворенного вещества 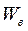 обычно выражают в долях единицы или в процентах. Например, если массовая доля серной кислоты в воде равна 0,05, или 5%, это означает, что в растворе серной кислоты массой 100г содержится серная кислота массой 5г и вода массой 95г.
обычно выражают в долях единицы или в процентах. Например, если массовая доля серной кислоты в воде равна 0,05, или 5%, это означает, что в растворе серной кислоты массой 100г содержится серная кислота массой 5г и вода массой 95г.
Для количественной характеристики растворов используется понятие концентрация - величина, характеризующая число частиц, отнесенное к единице объема. В химии концентрацию обычно измеряют не числом частиц, а числом молей в единице объема. Чаще всего используют молярную концентрацию.
Молярная концентрация, или молярность, - величина, равная
отношению количества растворенного вещества к объему раствора, т.е.
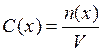
где С(х) - молярная концентрация частиц х; n(х) - количество вещества частиц х, содержащихся в растворе; V - объем раствора.
Основной единицей молярной концентрации является моль/л. Примеры записи молярной концентрации: С(НС1) = 0,1 моль/л, C( 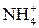 ) = 10 моль/л, С(
) = 10 моль/л, С( 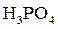 ) = 0,5 моль/л.
) = 0,5 моль/л.
Раствор, в 1 л которого содержится 1 моль растворенного вещества, называется молярным. Если в 1 л раствора содержится 0,1 моль вещества, то он называется децимолярным, 0,01 моль - сантимолярным, 0,001 моль - миллимолярным.
 Для расчетов в химии используется внесистемная единица - молярная доля. Молярная доля равна отношению числа молей данного вещества в растворе к общему числу молей веществ, образующих раствор (в общем случае число компонентов раствора i≥2)
Для расчетов в химии используется внесистемная единица - молярная доля. Молярная доля равна отношению числа молей данного вещества в растворе к общему числу молей веществ, образующих раствор (в общем случае число компонентов раствора i≥2)
где 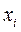 и
и 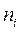 - молярная доля и число молей i-го компонента;
- молярная доля и число молей i-го компонента; 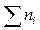 - общее число молей.
- общее число молей.
Например, для сплава Вуда, содержащего 1 моль Bi, 0,5 моль РЬ, 0,44 моль Sn и 0,46 моль Cd, молярная доля последнего равна
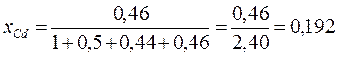
Дата добавления: 2016-11-26; просмотров: 7581;











