ИЗМЕНЕННЫЕ ЖИРНЫЕ КИСЛОТЫ
Изучение связи между патологическими состояниями и липидами постепенно привело нас к рассмотрению существования качественных изменений в указанных липидах, без учета количественных сдвигов. Существование патологических метаболических процессов и, особенно, тот факт, согласно которому подобные нарушения часто являются долговременными, трудно отнести исключительно на счет вариаций количества участвующих липидов. Более вероятно, что они происходят от изменений в природе самих участвующих липидов. Мы изучили этот вопрос присутствия жирных кислот при патологических состояниях.
Ориентиром направления поведения исследований для нас служила информация, предоставленная работами по прогорклости. Мы надеялись, что прогорклость поможет распознать происхождение качественных изменений, которые могут претерпевать липиды под влиянием ненормальных условий. Концептуально последние могут рассматриваться в качестве результата потери способности организма контролировать в достаточной мере происходящие процессы и удерживать их в рамках констант, характеризующих объект. Вследствие указанной утраты эффективного контроля, изменения, происходящие in vivo, при ненормальных условиях, могут тесно приближаться к тем, что происходят in vitro, где подобного контроля нет. Указанные здесь соображения побудили нас исследовать изменения, идентичные наблюдаемым при прогорклости, или происходящие in vivo в липидах, при ненормальных условиях.
Как отмечалось выше, при прогорклости первая группа изменений касается полярной группы. Некоторые из них приводят к появлению свободных жирных кислот, другие соответствуют изменениям в самих карбоксилах, а некоторые представлены процессами окисления, происходящими в цепи возле полярной группы. Вторая группа изменений при прогорклости касается неполярной группы и, особенно, присутствующих в ней энергетических центров, двойных связей.
Изучение последней группы изменений заставило нас рассмотреть те сдвиги, которые происходят in vitro в результате непосредственного воздействия кислорода и тепла. Как часть указанных изменений, особо важным считали конъюгацию двойных связей, образование которых наблюдали in vitro как шаг при окислении полиненасыщенных жирных кислот. Эта конъюгация соответствует характерному смещению в молекуле двух или более присутствующих двойных связей, будто приводя к параллельным взаимным положениям.
В то время как в простой связи два тетраэдрических атома углерода связаны своими вершинами, в двойной связи они связаны одним краем, а в тройной - поверхностью. В конъюгированном образовании общие края двух двойных связей, разделенные одной простой связью, являются, поэтому, параллельными. Плоскости, в которых электроны указанных двойных связей движутсяв каждой двойной связи, и которые являются перпендикулярными к таковой самой связи, становятся параллельными. Благодаря итоговой взаимной индукции их энергетическая величина увеличивается.
Руководствуясь, главным образом, информацией, полученной при изучении прогорклости, мы систематическим образом исследовали разные качественные нарушения, касающиеся жирных кислот.
Использованные методы исследования
Вслед за этим мы впервые исследовали формы, в которых обычно липиды присутствуют в организме. Мы использовали различия в растворимости между указанными разными формами, разделив их на свободные липиды, липиды, удерживаемые в лабильной связи с другими компонентами, как в синапсе, липиды, связанные через свою полярную группу, как в жирах, или в более сильной форме, такой как липиды в столь прочных сочетаниях, что их можно разъединить лишь путем омыления. Примененный в указанном исследовании метод и ряд примеров представлены в Заметке 8A. Это исследование показало, что при ненормальных условиях случаются очень важные вариации, что касается количеств разных форм. Из исследования становится ясно, что свободные липиды в большой степени ответственны за важные проявления, в которых липиды выступают в роли активных агентов.
В исследовании, касающемся измененного метаболизма карбоксила и рядом расположенных атомов углерода, мы изучили появление жирных альдегидов или кетонов в крови, моче и клетках.
Одной из главных встретившихся проблем было появление in vivo конъюгированных жирных кислот в качестве измененных жирных кислот. Чтобы убедиться в их наличии и измерить их количество мы использовали три разных метода исследования: спектральный анализ в ультрафиолете и в первой части видимого спектра (Заметки 8B); изучение расположения двойной связи в молекуле жирных кислот путем расщепления указанных молекул и анализа образующихся фракций. (See Заметки 1, Глава 10) Недавно мы испытали метод фракционирования паром (газовая хроматография) (Заметки 8C).
Первый и, особенно, второй метод, предоставил нам ценные данные, позволившие уяснить участие конъюгированных жирных кислот при болезненных состояниях. Указанные исследования выявили появление конъюгированных жирных кислот, особенно триенов, увеличение их количества с прогрессированием болезней и, особенно, факт, согласно которому, смерть наступает когда их концентрация в организме достигает критической величины. Это обусловило важность указанных веществ в патофизиологии. То, что газовая хроматография не выявляла присутствия конъюгированных жирных кислот, было обусловлено теми обстоятельствами, при которых метод в действительности работает.
Далее мы будем часто возвращаться к разным проблемам, связанным с участием конъюгированных жирных кислот. Таким образом, мы можем непосредственно связать участие указанных измененных жирных кислот в патогенезе проявлений множества болезней и состояний, таких как травма, шок, адреналэктомия, и, особенно, во вредных симптомах после облучения. (Глава 10)
При патологических изменениях обмена веществ, важным фактором является участие измененных жирных кислот в метаболизме хлоридных ионов, что приводит к особо прочному соединению иона хлора к атомам углерода в области двойных связей. Конъюгированные двойные связи в молекуле жирной кислоты оказались особенно удобными для этого, поскольку патологическая необратимая фиксация атомов хлора происходит в два этапа. Сначала галоген фиксируется к крайним атомам углерода конъюгированных образований со смещением двойной связи в промежуточное положение. Во вторую фазу, также происходит фиксация на промежуточные атомы углерода. (Заметки 8D)
В функциональном плане, жирные кислоты вызывают активизацию кислорода в виде нормального процесса, тем не менее, появление перекисей, или необратимой фиксации ионов хлора, представляет собой ненормальное событие.
Именно ненормальная фиксация ионов хлора конъюгированными жирными кислотами приводит к много более сложной группе процессов, включая метаболизм хлорида натрия. Если ион хлора фиксирован, ион натрия остается свободным для вхождения в иные комбинации, особенно, с ионом карбоната, образуя сильно щелочные соединения. Этот процесс объясняет появление местного алкалоза в результате вмешательства конъюгированных измененных жирных кислот, что соответствует хлоридной фазе "D."
Деление жирных кислот на четыре группы—1) насыщенные и мононенасыщенные, 2) ди-, ти- и, возможно. также тетра-ненасыщенные, 3) тера- и более высокие полиненасыщенные, и 4) конъюгированные - соответствуют схематически четырем основным ролям—калорической, организационной, функциональной и патогенной —которые жирные кислоты играют в организме. Указанные роли, вероятно, диктуются как разной структуой жирных кислот, так и разными веществами, с которыми они преимущественно связаны. Судьба жирной кислоты в организме кажется очень зависимой от ее связи с другими веществами. Как уже отмечалось, мы назвали указанные другие вещества "антижирными кислотами".
АНТИЖИРНЫЕ КИСЛОТЫ
Глицерин и глицерофосфорная кислота
Общепринятым фактом является осуществление всасывания в кишечнике и циркуляции жирных кислот благодаря связыванию с разными веществами. Анализ этого всасывания показывает, однако, что разные жирные кислоты обладают предпочтительными связями. Для насыщенных и monoethenic жирных кислот - это, главным образом. связь с глицерином. Хотя моноглицериды и диглицериды могут обнаруживаться в клетках кишечной слизистой оболочки, указанные жирные кислоты покидают кишечник в виде триглицеридов, образуя большую часть хиломикронов. Они также сохраняются
про запас в жировых клетках в качестве триглицеридов. Диеновые, триеновые и даже тетраеновые жирные кислоты обычно включаются в оборот в виде фосфолипидов, то есть в прямом сочетании с глицерофосфорными ионами. Полиненасыщенные кислоты связаны со стеринами, когда они попадают в кровь, циркулируют и откладываются. В то время как структуры разных жирных кислот определяют разную роль в организме, именно антижирокислотные составляющие, с которыми они связаны, увеличивают указанные роли. Изучение антижирных кислот показало, что указанные вещества способны даже сами диктовать разные судьбы для разных жирных кислот, которые они связывают.
Сочетание глицерина с любой жирной кислотой, вероятно, означает калорический метаболический характер. Это касается очень разных жирных кислот, обнаруживаемых в растениях и у животных в виде триглицеридов. Даже рицинолеиновый триглицерид, если он свежий, применяется в качестве съедобного масла, касторового масла. То же самое касается масла глицеридов полиненасыщенных жирных кислот, обнаруживаемых в жире морских животных. В семенах, все триглицериды жирных кислот, даже в конъюгированных, таких как элеостеариновая и parinaric, служат источниками энергии.Возможно, именно его сочетание с глицерином придает всем указанным жирным кислотам ценность в качестве калорических метаболитов. То же справедливо для связи с глицерофосфорным ионом.
Сочетание с глицерофосфорной кислотой придает разным жирным кислотам способность участвовать в создании мембран. Связь со стеринами, наоборот, индуцирует максимальную функциональную активность, придавая самой жирной кислоте структуру, обеспечивающую эту функцию.
Влияние, оказываемое антижирными кислотами, можно уяснить по тем изменениям, которые они индуцируют в активности жирных кислот Поскольку активность последних в большой мере связана с их присутствием в качестве свободных веществ, именно благодаря, главным образом, их сочетанию с жирными кислотами и проявляют себя антижирные кислоты. Инактивируя указанные свободные жирные кислоты, образующие мембрану и обеспечивающие ее проницаемость, антижирокислотный агент может изменить проницаемость вплоть до ее полной непроницаемости. Таким же образом, антижирная кислота, сочетаясь с полиненасыщенной жирной кислотой, может уменьшать и даже подавлять ее функциональную активность. Следует отметить, что, изменяя проницаемость и подавляя функциональную активность, антижирные кислоты оказывают свое влияние главным образом, нарушая обмен кислорода. С этой точки зрения, метаболизм становится преимущественно аноксибиотическим, в отличие от нормального оксибиотического метаболизма. Для глюкозы, например, подавление окислительной фазы приостанавливает метаболизм на pyruvic кислоте, которая переходит в молочную кислоту. Появление кислотных веществ в качестве биологического эффекта действия антижирных кислот приводит фактически, благодаря уменьшению активности жирных кислот, воздействуя на окислительные процессы непосредственно, или косвенно, посредством уменьшения мембранной проницаемости.
В то время как одна группа антижирных кислот может непосредственно связываться с гидроидами и, особенно, с глицерином, или с глицерином, связанным с фосфорной кислотой, как в глицерофосфорном ионе, другая группа представлена липоидами, сформированными, главным образом, производными характерной кольцеобразной системы, циклопепнтанфенантреном. Как антижирокислотные липоиды, указанные соединения, стероиды, представляли особый интерес при исследовании липоидов. Здесь будут обсуждаться лишь некоторые аспекты биологической активности стероидов, главным образом те, что представляют новый взгляд в изучении указанных веществ.
Стероиды
Фундаментальная роль указанных веществ в биологии определяется фактом их полицикличности. Это требует рассмотрения роли самого кольца в реактивности, как это показано в исследовании стероидов в качестве противоположности жирным кислотам. В жирных кислотах связи между атомами углерода, как в алифатической цепи, обеспечивают высокую взаимную мобильность между указанными атомами углерода. В результате, вся алифатическая цепь является высоко гибкой. С другой стороны, ригидность характерна для всех колец и усиливается полицикличностью молекул. Составляющие молекул удерживаются в фиксированных взаимных положениях. В то время как в жирных кислотах гибкость цепи позволяет энергетическим центрам занимать разные положения относительно друг друга и по отношению к другим молекулам, ригидность полициклических молекул поддерживает энергетические центры цикла, или тех, что присоединены к нему, в тех же положениях друг по отношению к другу. Указанное фундаментальное свойство циклических молекул оказалось важным фактором при определении биологической роли разных агентов, имеющих в составе своих молекул подобные циклы.
В случае со стероидами, это свойство приобретает особую значимость. Понимания разных видов биологической активности стероидов можно добиться, проводя анализ сил, которые являются результатов описанной выше характерной конфигурации. Кроме энергетических центров образований, подсоединенных к нему, два энергетических центра проявляют себя, как части самого стероидного ядра. Один находится у С3 и другой представлен циклопентановой группой. То, что указанные центры удерживаются в фиксированных положениях друг относительно друга благодаря ригидности этого полицикличного ядра, придало самому ядру важное свойство, которое выразилось в двухполярности этой молекулы. Изучение двух указанных энергетических центров послужило уяснению роли стероидов.
Изучение полярных групп, связанных с C3 циклического скелета стероидов позволило нам установить те состояния, которые индуцируют усиление активности этих полярных групп, а указанные условия обычно происходят в естественно встречающихся членах. Таким образом, можно отметить, что реактогенность любого кислорода, связанного с C3 увеличивается, если другая двойная связь, присутствующая в цикле является параллельной двойной связи, через которую кислород связан с;
C3. Двойная связь между C4 и C5, как показано на Рис 64 (a), удовлетворяет подобному состоянию.
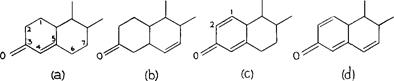
Рис. 64. Влияние, оказываемое на кислородную связь в C3 положением двойной связи в циклах 1 и 2 молекулы циклопентанфенантрена. Параллелизм между двойной связью кислорода и таковым, присутствующим между C4 и C5 увеличивает энергетическое свойство карбонила (a). Такое же влияние, но менее активное, оказывает двойная связь между C6 и C7. Двойная связь, добавленная между C1 и C2 (c) увеличивает активность. Еще большая активность будет произведена тройной связью, добавленной между C6 и C7 (d).
Идентичное влияние оказывается косвенно двойной связью между C6 и C7 (b) которая, благодаря индукции, окажет влияние на параллельную связь C4 и C5, а далее и на двойную связь кислорода. Это объясняет влияние, оказываемое двойной связью, присутствующей между C1 и C2 (c), как это наблюдается в синтетическом преднизолоне. Дальнейшее увеличение реактогенности получают при добавлении третьей двойной связи между C6 и C7. Параллелизм между тремя двойными связями (d) приведет к увеличению реактогенности.
Для гидроксила, такая же повышенная реактогенность индуцируется путем двойного связывания атома углерода, к которому двойной связью присоединен гидроксил к C3 – C4 или C2 – C3, как показано на Рис. 65 (a и b). A :
идентичное условие выполняется, если в молекуле присутствует двойная связь;
параллельно любой из этих связей, как показано на Рис 65 (c) где двойная связь находится между C5 и C6. Увеличенная реактогенность указанных соединений будет получена тогда, когда имеется одна двойная связь между Сз и C4 а другая - между C5 и C6 (d).
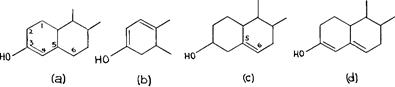
Рис. 65. Влияние, оказываемое на гидроксильную связь у C3 двойной связью в цикле 1 и 2 фенантрена увеличивается, если двойная связь соседствует или является параллельной связям С3, несущего гидроксил.
Мы вернемся к этому важному вопросу влияния двойных связей в циклических молекулах.
Энергетические свойства циклопентановой группы, как было установлено, связаны с нечетных числом атомов углерода. Переменная последовательность атомов углерода, имеющих положительный и отрицательный характер, являющаяся результатом индукционного эффекта, приводит к тому, что два атома углерода этого кольца имеют один и тот же знак. Это "близнецовое образование" индуцирует особую реактогенность молекул, связанную с пентановым кольцом молекулы стероида. (Заметки 9)
Особая реактогенность, наблюдаемая у Сз молекулы циклопентанфенантрена можно объяснить, используя гипотезу, раскрывающей происхождение указанных веществ. Хотя происхождение молекулы холестеина путем циклизации сквалена (35) выглядит весьма вероятным, это вряд ли можно отнести к кортикоидам. Мы попытались связать их происххождение с арахидоновой кислотой.
Ряд соображений, таких как высокие уровни арахидоновой кислоты и кортикоидов в надпочечниках, а также уменьшение первых, когда значительные количества последних выделяются (Заметки 10), вероятно, служит основанием, устанавливающим корреляцию между указанными веществами. В соответствии с нашей гипотезой, стероиды с двууглеродной цепью у C17, присутствующие у кортикоидов и лютеоидов, образуются в результате циклизации молекулы арахидоновой кислоты (Заметки 11) Это объясняет особую реактивность Сз, которую можно отнести на счет C9 арахидоновой кислоты, связанного в этой молекуле двойной связью.
Изучение разных стероидов в указанном энергетическом аспекте позволило нам понять их физиологические свойства.
Притом, что С3 имеет гидроксил или кислород в качестве полярной группы почти у всех стероидов, разнообразие биологических свойств будет обусловлено разными условиями на другой оконечности молекулы, главным образом у C17, что вытекает из особых энергетических условий, преобладающих в указанной области молекулы. Простейшие стероиды представлены теми, которые имеют полярную группу, составленную из OH или 0, присоединенных к C17. Эти стероиды, встречающиеся в естественных условиях, обладают свойствами, относящимися к вторичным половым признакам. Здесь мы их кратко обсудим.
Половые гормоны
Эта группа стероидов имеет две полярные группы, одну у С3 и вторую - у C17. Энергетический центр у С3 может иметь отрицательный или положительный полярный характер, в зависимости от присутствия кислорода или гидроксила. Энергетический центр у C17 также может иметь кислород или гидроксильную группу и, таким образом, может быть положительным или отрицательным. Важным фактором для свойств вещества является связь между двумя полярными группами в одной и той же молекуле. Очевидно, что полярность молекулы варьирует, в зависимости от вида присутствующей полярной группы у Сз и C17. В простейшем прочтении концепции, которое мы считаем точной только отчасти, следует связать указанную полярность с гормональными характеристиками мужского и женского пола.
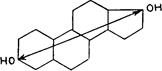
В простых молекулах стероидов фолликулиноидное,или эстрогенное, биологическое свойство придается в случаях, когда две полярные группы—у С3 и C17 —образуются гидроксилами. Выходит, что молекуле свойственна двуположительная полярность. Следует признать важным то, что эти два гидроксила оставались в сравнительно фиксированных взаимных положениях—соответствующие С3 и C17 в качестве части твердого скелета стероидов. Эстрогенные свойства имеются у разных стероидов, удовлетворяющих указанному условию. Более того, вещества, отстоящие далеко от стероидов, обладают фолликулиноидными свойствами, если они обладают указанной связью между двумя гидроксилами. Как показано на Рис 66 диэтилстильбэстрол, который обладает двумя гидроксилами, удерживающимися в фиксированных положениях, подобных таковым у эстрогенных стероидов, также демонстрирует мощную эстрогенную активность.
|
|
ЭстрадиолДиэтилстильбэстрол
Рис. 66. Фолликулиноидная активность, как было установлено, связана с существованием двух гидроксилов, удерживаемых в одном и том же относительном положении, как это видно у эстрадиола и диэтилстильбэстрола.
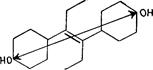
Подобным же образом мы попытались связать тестоидную активность с присутствием положительно-отрицательной полярности; которая, при энергетически разных двух полярных центрах, одном, соответствующим кислороду и втором - гидроксилу, удерживаются в одном и том же фиксированном положении. Важность этой относительной стериновой позиции двух полярных групп для тестоидной активности становится очевидной когда, она обнаруживается в веществах, не относящихся к тестостерону, главному мужскому гормону, имеющему кислород у С3 и гидроксил - у C17. Тестоидная активность присутствует в андростероне, имеющем кислород и гидроксил, занимающих одинаковые соответствующие положения, хотя кислород здесь находится у C17 - и гидроксил - у С3, в противоположность тестостерону. У обоих веществ, тестостерона и андростерона, удовлетворяются два необходимых для тестоидной активности условия, положительно-отрицательная полярность и одна и та же относительная позиция между полярными группами. (Рис. 67) Различия, существующие между указанными веществами, учитывая их специфическую гормональную активность, могут объясняться разным влиянием, оказываемым на две полярные группы в этих веществах остальной частью молекул.
|

|
Тестостерон Андростерон
Рис. 67. Активность тестоида, вероятно, связана с присутствием гидроксила или карбонила в одном и том же фиксированном относительном положении, которое обеспечивается жесткостью молекулы стероида. Такая же позиционная взаимная связь существует между указанными двумя полярными группами в тестостероне и андростероне.
Тестоидная активность, обнаруживаемая у кортизона, гидрокортизона и прочих гормонов, также может объясняться присутствием в указанных молекулах кислорода и гидроксила у С3 и C17, а также сохранением фиксированного положения между двумя полярными группами.
С концептуальной точки зрения, антагонизм между эстрогенной и тестоидной биологической активностями можно считать точно обусловленной различиями в полярности, которая в той или иной форме можно обнаружить в других факторах, служащих для разделения полов. Здесь мы просто заметим, что такое же отличие мужским и женским началом наблюдается в половых хромосомах, в которых женская характеристика связана с хромосомами XX, а мужская - с хромосомами X и Y. Как мы увидим далее, обычно существует связь между липидами и полом.
Кроме половых гормонов, жирные кислоты оказались связаны с признаками мужского пола, в то время как женские признаки связаны с другой группой стероидов - стеринами.
Стерины
Характерной особенностью структуры этой группы стероидов является присутствие гидроксила у C3 связи длинной цепи - у C17. Через гидроксил
центр уС3 имеет нуклеофильный характер. Он еще более усиливается присутствием двойной связи между C5 и C6, которая, имея параллельную связь между С3 и C4, увеличивает ее ионный характер и также реактогенность гидроксильной связи к С3. Через указанный гидроксил стерины обычно комбинируются с веществами, имеющими отрицательную полярную группу, образуя эфиры.
Кроме способности обычно комбинироваться с жирными кислотами, одним из важнейших свойств главного стерина животных, холестерина, является его селективная аффинность к определенным членам ряда жирных кислот, полиненасыщенным. Мы попытались объяснить специфичность указанной связи через интересный процесс, который можно назвать "стериновая ассоциация".
При указанном процессе две молекулы, обычно липоиды, удерживаются вместе не только за счет комбинации своих полярных групп, но также и связи между их неполярными частями. Две эти молекулы взаимно притягиваются множеством сил, имеющихся в неполярных группах. Некоторые связаны с присоединенными центрами, в то время как некоторые, те что соответствуют силам сцепления, относятся к самим кольцам. Важным фактором является ригидность молекулы стерина, позволяющая другой молекуле, если она сгибаема, создавать стериновую ассоциацию. Ригидный скелет не только удерживает энергетические центры одной молекулы в фиксированном положении, но и позволяет сгибаемой алифатической цепи укрывать полициклическую молекулу, но и, таким образом, способствовать контакту энергетических центров одной молекулы с таковыми другой молекулы. Подобным образом стериновая ассоциация завершает связывание полярных групп. Чем больше соответствие между энергетическими центрами обеих молекул, более совершенной получится образующаяся ассоциация и более полной взаимная нейтрализация энергетических центров двух молекул. Стериновая ассоциация объясняет, почему, из всех присутствующих в организме жирных кислот, холестерин предпочитает связываться с теми, что имеют полиненасыщенные цепи. Именно указанные жирные кислоты обладают несколькими энергетическими центрами в неполярной группе, представленными двойными связями. Длинные цепи молекул указанных жирных кислот, имеющих определенную степень сгибаемости, затем завершат процесс стериновой ассоциации. (Заметки 12)
Стериновая ассоциация, в дополнение к своему общебиологическому значению, где она представляет вид молекулярной реактогенности, вероятно, объясняет антагонистическое влияние, оказываемое разными составляющими, особенно стеринами и полиненасыщенными жирными кислотами. Благодаря стериновой ассоциации холестерин может влиять на активность указанных жирных кислот более непосредственно относящихся к неполярной группе. Тем не менее, следует подчеркнуть, что нейтрализация, являющаяся результатом стериновой ассоциации, не является необратимой. И наоборот, благодаря вмешательству разных факторов, таких как разрыв связи между полярными группами, две сдвоенные молекулы могут восстановить свою независимость. Это объяснит некоторую лабильность комбинаций между жирными кислотами и стеринами. Антагонизм между жирными кислотами представляет важный аспект биологического дуализма, который обсудим в деталях далее, когда указанные вещества будут изучаться в связи с их влиянием на разных уровнях организации.
Стероиды с двух углеродной цепью
Среди наиболее важных стероидов те, что имеют двууглеродную цепь, фиксированные у C17.
Две группы, лютеоиды и кортикоиды, оказались непосредственно связанными с углеводом аллопрегнаном, полициклическим стероидом с двууглеродной боковой цепью, фиксированной у C17. Как мы уже увидели на примере гипотезы о происхождении стероидов (Заметки 11), указанный углевод может непосредственно происходить из арахидоновой кислоты, при том что двууглеродная латеральная цепь соответствует хвостовой цепи этой кислоты, а хвост является остатком после циклизации.
Лютеоиды
Прототипом лютеоидов является прогестерон. Присутствуют две полярные группы С = О, одна у Сз полицикла и другая у C20 хвостовой цепи. Параллельная двойная связь между C4 и C5 завершает формулу. Энергетически, прогестерон представляет первый центр у С3, которому свойственна сильная нуклеофилия по двум причинам. Первая - то, что он соответствует мощному электроотрицательному С3, вторая - потому что он усилен двойной связью, имеющейся между C4 и C5, и которая оказывается параллельной двойной связи карбонила. Вторая = 0 присоединена к C20 хвоста цепи. Она также усиливается благодаря тому, что двойная связь этого карбонила параллельна связи между C13 и C17, которая в циклопентане, в соответствии с гипотезой двойных атомов углерода, связывает с двумя отрицательно заряженными атомами углерода. По своему строению прогестерон является также лютеоидом, при преобладании сложной углеводной группы над полярными группами. Благодаря своим полярным нуклеофильным центрам прогестерон имеет фундаментальный характер кислотных липоидов. Лютеоидная активность прогестерона соответствует присутствию двух сравнительно сильных нейтрофильных центров, сохраняющих свое характерное положение, один - у C3 и другой - у C20.
Мы наблюдали, что любое нарушение в этой энергетической картине, любое изменение динуклеофильности в любом центре, уменьшает лютеоидные свойства вещества. При более глубоких изменениях, лютеоидная активность даже подавляется. (Заметки 13)
Кортикоиды
Кортикоиды представляют группу гормонов, привлекших внимание ученых в связи с их новыми лечебными применениями.
Химически они идентичны лютеоидам, производным того же родительского углеводорода, аллопрегнана. Структурно все указанные адренокортикоиды имеют: а) С3, связывающий 0 группу; b) двойную связь между C4 и C5 в первом цикле; c) двухуглеродную хвостовую цепь с 0, присоединенным в кетоновой форме к C20; d) OH, в качестве первичного спирта, присутствующего у C21. Указанная структура, одинаковая у всех кортикоидов, вероятно, ответственна за основные свойства этих веществ. Кортикоиды были разделены на подгруппы, в зависимости от присутствия присоединенных групп OH или = 0 у C11 или OH у C17 . Наличие или отсутствие присоединенных радикалов у C11 оказалось самым важным. Кортикоиды без присоединенных радикалов у C11 оказывают наибольшее влияние на метаболизм электролитов. Вторая группа кортикоидов, имеющих радикал, известны как неоглюкогенные кортикоиды. В этом названии отражены их основные биологические характеристики.
В энергетическом плане кортикоиды обладают нуклеофильным центром у Сз, усиленого присутствием двойной связи в цикле между C4 и C5. Эта двойная связь аналогична двойной связи карбоксила, что позволяет ей индуктивно увеличить ионный характер последней.
Вторая энергетическая группа хвостовой цепи появляется in toto в качестве сильного три полюсного центра с нуклеофильным центром у C20 этой цепи и электрофильным центром у C21 (Заметки 14) К этой основной модели добавляется, в неоглюкогенном кортикоиде, отдельный энергетический центр у C11, который может быть как электрофильным, образованным гидроксилом, так нуклеофильным, образованным кислородом.
Кортикоиды обычно действуют как положительные липоиды. (Заметки 15) Из-за их важности, в связи с антижирокислотной активностью, сначала мы обсудим неоглюкогенные кортикоиды, членов с полярной группой, расположенной также у C11. В соответствии с нашей гипотезой, указанные стероиды обладают особой биологической активностью, участвуя в процессе синтеза в организме. Часть молекулы между C11 и C21 представляет энергетическое образование с особенным свойством. Она представляет род энергетического шаблона, в котором каждый атом углерода имеет свой особый энергетический характер. Разные радикалы будут привлекаться этими энергетическими центрами этого шаблонного образования в соответствии с их собственной энергетической природой. Сохраняя свои соответствующие позиции, они подвергнутся индукции связаться вместе для образования новых веществ. Таким способом это шаблонное образование будет способствовать новому синтезу.
В разных кортикоидах состав образования C11 = C21 будет отличаться, и это будет определять, какое вещество должно быть синтезировано соответствующим шаблонным образованием. (Заметки 16)
Используя гипотезу о шаблонах, мы изучили весь ряд компонентов организма, образующих "глюко группу". Среди указанных веществ - глюкоза, галактоза, глюкозамин и галактозамин вместе с соответствующими им кислотами. В соответствии с нашей гипотезой, указанные неоглюкогенные кортикоиды будут выполнять важную роль образования, возможно, вместе с другими механизмами, полного ряда составляющих "глюко". Существование разных шаблонных образований приведет к образованию разнообразных синтезированных составляющих.
Участие шаблонного образования в синтезе может происходить много раз, не влияя на молекулу кортикоида как таковую. Здесь интересно отметить структурную странность, которую можно интерпретировать как связанную с активностью шаблона. В этом шаблоне группа последовательности C11, C12, C13 и C17 является частью ригидного скелета циклической молекулы, в то время как C20 и C21 образуют боковую цепь, присоединенную к C17. Это можно рассматривать как придание определенной достаточной мобильности этой боковой цепи по отношению к полициклу. Существует возможность того, что указанная боковая цепь станет замкнутым образованием, когда произойдет синтез. Движение цепи у C17 позволит плесени открыться, освобождая, таким образом, эту синтезированную молекулу. Интересно здесь отметить важность структуры шаблона для состава синтезируемых веществ. Кроме полярной группы у C17, который у C11 является также важным для неоглюкогенной активности, поскольку он обеспечивает шестиуглеродную цепь в синтезированных молекулах. Гидроксил карбоксила у C6 синтезированного вещества появится, в соответствии с происхождением полярной группы у C11 стероида. Относительные характер и положения C21 и C12 позволяют образоваться циклу, сформированному пятью атомами углерода и кислородом, что характерно для пиру формы новосинтезированных веществ.
Интересное подтверждение гипотезы шаблона получили, когда глюкозамин, который, в соответствии с гипотезой, синтезируется из молекулы кортизона, был признан индуцирующим у пациентов многие клинические проявления, наблюдаемые при лечении кортизоном. Далее мы рассмотрим указанные результаты при обсуждении лечения. Главная роль, которую играют глюкозамин, галактозамин и соответствующие мочевые кислоты, в составе соединительной ткани, представляют "утраченное звено" при объяснении связи между кортизоном, другими неоглюкогенными кортикоидами и указанной тканью. В какой то части полученный лечебный эффект от указанных неоглюкогенных кортикоидовпри болезнях соединительной ткани следует отнести на счет вмешательства аминосахаров.
При изучении антижирокислотной активности было установлено, что глицерин и глицерофосфорный ион контролируют абсорбцию и циркуляцию насыщенных моно-, ди-, или три-ненасыщенных свободных жирных кислот. Как оказалось, стерины уравновешивают нормальные полиненасыщенные члены, в то время как адреналокортикоиды и, особенно, неоглюкогенные кортикоиды обычно противодействуют токсическому воздействию жирных кислот в общем и конъюгированным членам в частности. Исследования, проводимые в наших лабораториях E. F. Taskier указывают на то, что надпочечники участвуют в защитном механизме против жирных кислот и, особенно, против конъюгированных членов, которые, как оказалось, связаны с патологическими состояниями. (Заметки 17)
Часть нашего исследования касалось роли липоидов в нормальной и патологической физиологии в свете концепции антагонизма между двумя группами, одной - с положительным и второй - с отрицательным полярным характером. Этот специфический аспект побудил нас изучить, вместе с жирными кислотами и антижирными кислотами, иные вещества, связанные с этим антагонизмом. В группе липокислот или кислотных липоидов, полученных из ткане<
Дата добавления: 2021-02-19; просмотров: 434;











