Теория гетерогенного горения углерода
В чистом виде гетерогенные реакции проявляются в крайне ограниченных областях температур, когда скорости этих реакций малы. Искажение закона реагирования вызывается появлением диффузионного торможения: диффузией кислорода и продуктов горения в объеме, окружающем горящую частицу и диффузией внутри массы кокса.
Физическая картина заключается в следующем: кислород подводится к внешней поверхности куска, на участках этой поверхности, где нет трещин, часть кислорода вступает в соединение с углеродом и выделяется определенное количество оксида и диоксида углерода.
При горении углеродной частицы можно выделить два основных процесса, определяющих скорость выгорания: диффузию кислорода к поверхности углеродной частицы и собственно скорость химического реагирования кислорода с углеродом [18].
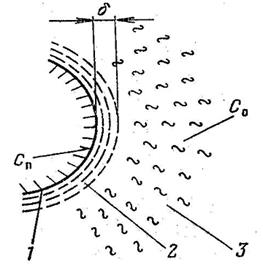
Рассмотрим общую теорию гетерогенного горения на примере горения одиночной углеродной сферической частицы, принимая следующие условия (рис. 4.1):
1. Концентрация кислорода по всей поверхности одинакова.
2. Реакция протекает на поверхности с образованием конечных продуктов, вторичное реагирование на поверхности и в газовом объеме отсутствует, т. е. идет только реакция (р1).
3. Имеет место реакция первого порядка по кислороду.
| Рис. 4.1. Схема горения углеродной частицы: 1 – поверхность частицы; 2 – пограничная пленка; 3 – зона турбулентного потока; с0 – концентрация кислорода в объеме газа; сп – концентрация кислорода на поверхности частицы; d - толщина диффузионного пограничного слоя |
Поток кислорода, поглощаемый за счет химического реагирования, может быть рассчитан по формуле, кг/(м2×с),
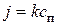 , (4.7)
, (4.7)
где k – константа скорости химического реагирования, м/с; сп – концентрация кислорода на поверхности частицы кокса, кг/м3. С другой стороны, поток кислорода, доставляемый за счет диффузии к реагирующей поверхности, кг/(м2·с),
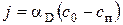 , (4.8)
, (4.8)
где aD – коэффициент диффузионного массообмена, м/с; с0 – концентрация кислорода в объеме газа, кг/м3.
Приравнивая потоки и исключая неизвестное значение концентрации углерода на поверхности сп, получим выражение для константы обобщающей скорости взаимодействия кислорода с горящей углеродной частицей, включающей как диффузионное сопротивление, так и сопротивление химической реакции, кг/(м2·с),
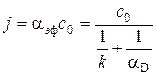 , (4.9)
, (4.9)
где αэф – коэффициент реакционного газообмена, м/с.
В области низких температур скорость химических реакций мала (рис. 4.2) и во много раз меньше k << aD ( 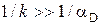 ) скорости, с которой кислород может быть доставлен диффузией к поверхности. Процесс ограничивается скоростью самого химического реагирования (j = kc0). Поэтому эта область протекания реакции получила название кинетической. Концентрация кислорода на поверхности частицы равна концентрации кислорода в объеме газа сп = с0. При высоких температурах горение в кинетической области может наступить при больших скоростях потока и малых размерах частиц топлива.
) скорости, с которой кислород может быть доставлен диффузией к поверхности. Процесс ограничивается скоростью самого химического реагирования (j = kc0). Поэтому эта область протекания реакции получила название кинетической. Концентрация кислорода на поверхности частицы равна концентрации кислорода в объеме газа сп = с0. При высоких температурах горение в кинетической области может наступить при больших скоростях потока и малых размерах частиц топлива.
| Рис. 4.2. Зависимость удельного потока реагирования антрацитов от температуры по опытам Л.Н. Хитрина [8] |
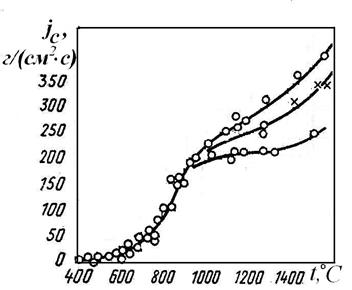
При высоких температурах скорость реакции, определяемая законом Аррениуса k=k0·exp[-E/(RT)], настолько возрастает, что процесс горения начинает лимитироваться скоростью доставки кислорода к частице k >> aD (1/k << 1/άD). Скорость реакции настолько велика, что доставляемый диффузией кислород мгновенно вступает в химическую реакцию сп→0. Скорость горения в этом случае определяется скоростью диффузии кислорода к поверхности частицы (j = άDc0), режим горения называется диффузионным.
При сжигании твердого топлива в плотном либо псевдоожиженном слое, горение крупных частиц идет обычно в диффузионной области. При пылевидном сжигании относительная скорость между газом и топливной частицей невелика, при этом число Шервуда стремится к двум: 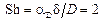 . В данном выражении коэффициент молекулярной диффузии рассчитываю как коэффициент взаимодиффузии кислорода в азоте
. В данном выражении коэффициент молекулярной диффузии рассчитываю как коэффициент взаимодиффузии кислорода в азоте
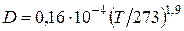 . (4.10)
. (4.10)
В данной области поток почти пропорционален температуре 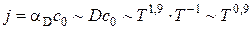 . С уменьшением диаметра частицы, падает диффузионное сопротивление
. С уменьшением диаметра частицы, падает диффузионное сопротивление 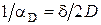 , т. е. уменьшение диаметра пылевых частиц, позволяет повысить скорость их горения.
, т. е. уменьшение диаметра пылевых частиц, позволяет повысить скорость их горения.
Дата добавления: 2016-11-26; просмотров: 2311;











