Основные химические реакции горения углерода
Экспериментальные исследования показали, что взаимодействие кислорода с углеродной частицей приводит к образованию как оксида, так и диоксида углерода. Механизм образования первичных окислов следующий: из газового объема кислород адсорбируется на поверхности углерода. На поверхности атомы кислорода вступают в химическое соединение с углеродом, образуя сложные углеродно-кислородные комплексы СхОу. Комплексы распадаются с образованием СО2 и СО. Скорость распада сильно увеличивается с ростом температуры. Кроме первичных реакций существенное влияние на скорость горения оказывают вторичные реакции: взаимодействие углерода с диоксидом углерода и реакция горения оксида углерода. Горение углерода можно формально характеризовать следующими химическими реакциями:
· первичные реакции углерода с кислородом:
С+О2=СО2+409,1 МДж/моль, (р1)
2С+О2=2СО+2×123,3 МДж/моль; (р2)
· вторичная гомогенная реакция горения оксида углерода в пограничном слое:
2СО+О2=2СО2+2×285,8 МДж/моль; (р3)
· вторичная гетерогенная реакция взаимодействия диоксида углерода с углеродом
С+СО2=2СО–162,5 МДж/моль. (р4)
При гетерогенном горении углерода реакция протекает на его поверхности, к которой поступают молекулы кислорода из газового объема. Обычно считают, что изменение констант скоростей реакций от температуры подчиняется закону Аррениуса. Тогда для каждой гетерогенной реакции будет справедливо равенство
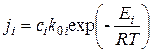 , (4.5)
, (4.5)
где i – номер реакции.
В настоящее время имеется обширный экспериментальный материал по значениям кинетических констант реакций углерода различных видов топлива с газами. Энергия активации для реакции (р1), для коксов различных топлив имеет следующие значения, кДж/моль:
древесный уголь………………………...75-84
торф……………………………………....85
бурый уголь…………………………...…90-105
каменный уголь………………………….115-135
тощий уголь и антрацит…………………140-146
электродный уголь…………………...….167
На основании экспериментальных данных обнаружена связь между величиной энергии активации Е, Дж/моль, и величиной предэкспоненциального множителя, который может быть рассчитан по выражению [17]
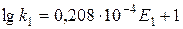 . (4.6)
. (4.6)
Исследования показали, что между энергиями активации различных реакций углерода с О2 и СО2 для одного и того же кокса имеется определенная связь: Е2/Е1 = 1,1; Е3/Е1 = 2,2.
Дата добавления: 2016-11-26; просмотров: 3067;











