Основные этапы развития геохимии
ГЕОХИМИЯ (от греч. ge- Земля и химия), наука о распространенности и миграции хим. элементов в геосферах. Геохимия как наука возникла из тесной взаимосвязи физики и химии с науками о Земле: минералогией петрографией и геологией.
Основы геохимии разработаны в нач. 20 в. В. И. Вернадским, А. Е. Ферсманом, В. М. Гольдшмидтом и Ф. У. Кларком.
Термин «геохимия» был введен немецким химиком Х. Шенбейном (1799 – 1868)
Важнейшие этапы:
1. Открытие в 1859 году Р. Бунзеном и Г.Кирхгофом спектрального анализа;
2. Открытие в 1869 году Д.И. Менделеевым периодического закона химических элементов
3. Ф.У. Кларк в 1889 году дал первую сводную таблицу среднего химического состава земной коры
4. 1896г. – открытие радиоактивности;
5. 1898 г. – открытие электрона Дж.Томсоном
6. 1898 г. – открытие сильно радиоактивных элементов радия и полония П. Кюри и М. Кюри;
7. 1912г. - открытие дифракции рентгеновских лучей в кристаллах и экспериментальное доказательство атомного строения кристаллических веществ.
8. 1913 г.- установлен закон Мозли согласно которому порядковый номер в таблице Д.И. Менделеева равен заряду атомного ядра;
9. на основе квантовой теории Н.Бор предлагает модель атома;
10. 1925 – 1927 закладываются основы квантовой механики Л. де Бройлем,
11. Э. Шредингером, В. Гейзенбергом;
12. 1924 – В.М. Гольдшмидт предложил геохимическую классификацию элементов;
13. 1926 – введение В.М. Гольдшмидтом понятие изоморфизма
14. 1924 - 1932 – разработка В.И. Вернадским учения о биосфере.
В 1960-х годах начался расцвет геохимии, продолжающийся до сих пор. За это время в науке произошёл существенный прогресс. Атмосферная и морская геохимия интегрировались в геохимию твёрдой Земли; космохимия и биогеохимия внесли огромный вклад в наше понимание истории нашей планеты. Началось изучение Земли как единой системы.
Масштабные морские экспедиции показали, как и насколько быстро смешиваются воды океанов, они продемонстрировали связь между морской биологией, физической океанологией и морским осадконакоплением. Открытие гидротермальных источников показало, как формируются рудные месторождения. Были открыты прежде неизвестные экосистемы, и были выяснены факторы, которые управляют составом морской воды.
Теория тектоники плит преобразила геохимию. Геохимики наконец поняли поведение осадков и океанической коры в зонах субдукции, их погружение и эксгумацию. Новые эксперименты при температурах и давлениях глубин Земли позволили выяснить, какова трехмерная структура мантии и как происходит генерация магм. Доставка на Землю лунных пород, исследование с помощью космических аппаратов планет и их спутников и успешный поиск планет в других звёздных системах произвели революцию в нашем понимании Вселенной.
Задачи геохимии
1. Определение относительной и абсолютной распространённости элементов и изотопов в Земле и на её поверхности.
2. Изучение распределения и перемещения элементов в различных частях Земли (коре, мантии, гидросфере и т. д.) для выяснения законов и причин неравномерного распределения элементов.
3. Анализ распределения элементов и изотопов в космосе и на планетах Солнечной системы (космохимия).
4. Изучение геологических процессов и веществ, производимых живыми или вымершими организмами (биогеохимия).
5. Согласно В.М. Гольдшмиту, абсолютные количества элементов (кларки) зависят от строения атомного ядра, а их распределение, обусловленное миграцией, от строения электронных оболочек.
В соответствии с задачами геохимию подразделяют на:
1. Геохимия гидросферы
Происхождение гидросферы. Химический состав вод гидросферы. Эволюция состава гидросферы в истории Земли. Глобальный круговорот воды на Земле. Вода в мантийных минералах. Физико-химический контроль морской воды
2. Геохимия атмосферы
Происхождение атмосферы. Состав атмосферы. Эволюция состава атмосферы
3. Геохимия осадочных пород
Химический состав и минералогия осадочных пород. Поведение элементов в ходе выветривания. Образование и диагенез карбонатных пород. Органическое вещество в осадках. Образование докембрийских кремнистых сланцев
4. Геохимия земной коры
Рост и эволюция континентальной коры. Распространенность элементов в земной коре. Минералы в земной коре. Химический состав и классификация магматических пород. Поведение компонентов примесей.
Гранитоиды. Проблема формирования гранитоидов. Геохимия продуктов островодужного вулканизма. Геохимия морских базальтов. Типы морских базальтов и их геохимия. Типы метаморфизма, метаморфические фации.
Химическая геодинамика зон субдукции. Поведение элементов в зонах субдукции.
5. Изотопная геохимия
Механизмы распада радиоактивных атомов. Закон радиоактивного распада. Изотопная геология радиогенных изотопов. Методы определения абсолютного возраста. Стабильные изотопы
6. Геохимия магматических, метаморфических, гидротермальных процессов.
7. Биогеохимия
Зависимость физических свойств вещества от химического состава определяет взаимосвязь геохимии и геофизики.
СТРОЕНИЕ АТОМА
А́том (др.-греч. ἄτομος — неделимый) — наименьшая химически неделимая часть химического элемента, являющаяся носителем его свойств. Атом состоит из атомного ядра и окружающего его электронного облака. Ядро атома состоит из положительно заряженных протонов и электрически нейтральных нейтронов, а окружающее его облако состоит из отрицательно заряженных электронов. Если число протонов в ядре совпадает с числом электронов, то атом в целом оказывается электрически нейтральным. В противном случае он обладает некоторым положительным или отрицательным зарядом и называется ионом. Атомы классифицируются по количеству протонов и нейтронов в ядре: количество протонов определяет принадлежность атома некоторому химическому элементу, а число нейтронов — изотопу этого элемента.
Модели атома: 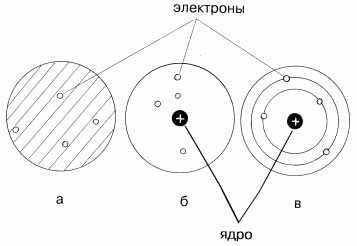
а) Томсона («сливовый пудинг», модель «Пудинг с изюмом», англ. Plumpuddingmodel). Дж. Дж. Томсон предложил рассматривать атом как некоторое положительно заряженное тело с заключёнными внутри него электронами. Эта модель не объясняла дискретный характер излучения атома и его устойчивость. Была окончательно опровергнута Резерфордом после проведённого им знаменитого опыта по рассеиванию альфа-частиц.
б) Резерфорд. Проделав ряд экспериментов, пришёл к выводу, что атом представляет собой подобие планетной системы, в которой электроны движутся по орбитам вокруг расположенного в центре атома тяжёлого положительно заряженного ядра («модель атома Резерфорда»). Однако такое описание атома вошло в противоречие с классической электродинамикой. Дело в том, что, согласно классической электродинамике, электрон при движении с центростремительным ускорением должен излучать электромагнитные волны, а, следовательно, терять энергию. Расчёты показывали, что время, за которое электрон в таком атоме упадёт на ядро, совершенно ничтожно.
в) планетарная модель Бора. Для объяснения стабильности атомов Нильсу Бору пришлось ввести постулаты, которые сводились к тому, что электрон в атоме, находясь в некоторых специальных энергетических состояниях, не излучает энергию («модель атома Бора-Резерфорда»). Постулаты Бора показали, что для описания атома классическая механика неприменима. Дальнейшее изучение излучения атома привело к созданию квантовой механики, которая позволила объяснить подавляющее большинство наблюдаемых фактов.
Современная модель атома является развитием планетарной модели. Согласно этой модели, ядро атома состоит из положительно заряженных протонов и не имеющих заряда нейтронов и окружено отрицательно заряженными электронами. Однако представления квантовой механики не позволяют считать, что электроны движутся вокруг ядра по сколько-нибудь определённым траекториям (неопределённость координаты электрона в атоме может быть сравнима с размерами самого атома).
Электро́нво́льт (сокращённо эВ или eV) — внесистемная единица измерения энергии, широко используемая в атомной и квантовой физике. Один электронвольт равен энергии, которая необходима для переноса электрона в электростатическом поле между точками с разницей потенциалов 1В. Так как работа при переносе заряда q равна qU (где U — разность потенциалов), а заряд электрона составляет −, 1,602 176 487(40)×10−19 Кл то
1 эВ = 1,602 176 487(40)×10−19 Дж = 1,602 176 487(40)×10−12 эрг.
Атомная единица массы (а.е.м.) равна 1/12 массы m атома углерода 12С (m одного атома 12С равна 1,993 • 10-26 кг).
Относительная атомная масса элемента («атомная масса, «атомный вес») (Ar) – это безразмерная величина, равная отношению средней массы атома элемента к 1/12 массы атома 12С. При расчете относительной атомной массы учитывается изотопный состав элемента.
Абсолютная масса атома (m) равна относительной атомной массе, умноженной на 1 а.е.м. Например, для атома водорода абсолютная масса определяется следующим образом:
m(H) = 1,008 • 1,661 • 10-27 кг = 1,674 • 10-27 кг
Важным шагом на пути создания теoрии строения атомов явилось предположение М. Планка, что энергия электромагнитного излучения выделяется порциями, или квантами. Энергия излучения одного кванта равна:
E =hυ, h -коэффициент пропорциональности (постоянная Планка)
В 1913 году Н. Бор предложил теорию строения атома. Он постулировал, что для электрона в атоме водорода допустимы только такие орбиты, на которых угловой момент электрона представляет собой целочисленное кратное постоянной Планка деленное на 2p:
mevr = n (h/2p)
Постулат Бора приводит к ограничению энергии электрона в атоме водорода значениями E = -k/n2 где n = 1,2,3,4,… k –константа зависящая только от постоянной Планка, массы электрона и его заряда: k = 2p2mee4/h2
В атоме существуют орбиты, находясь на которых электрон не излучает энергию. Эти орбиты называются стационарными.
Атомы состоят из положительно заряженного ядра и электронного облака. а) состав ядра атома водорода входит только 1 протон, а электронное облако заполняется одним электроном. б) В ядре атома углерода 6 протонов и 6 нейтронов, а в электронном облаке - 6 электронов. в) Существует также изотопный углерод, ядре которого на 1 нейтрон больше. Содержание этого изотопа в природном углероде составляет чуть более 1% (об изотопах см. ниже). Линейные размеры атомов очень малы: их радиусы составляют от 1 до 2,5 ангстрема (1 ангстрем = 10-8 см). Радиус ядра около 10-5 ангстрема, то есть 10-13 см. Это в 100000 раз меньше размеров электронной оболочки. Поэтому правильно показать отноительные пропорции ядер и электронных оболочек на рисунке невозможно. Если бы атом увеличился до размеров Земли, то ядро имело бы всего около 60 м в диаметре и могло бы поместиться на футбольном поле.
Электрон является самой лёгкой из составляющих атом частиц с массой 9,11×10−28 г, отрицательным зарядом и размером, слишком малым для измерения современными методами.[11] Протоны обладают положительным зарядом и в 1836 раз тяжелее электрона (1,6726×10−24 г). Нейтроны не обладают электрическим зарядом и в 1839 раз тяжелее электрона (1,6929×10−24 г).[12] При этом масса ядра меньше суммы масс составляющих её протонов и нейтронов из-за эффекта дефекта массы.
Атомы элементов стремятся к наиболее устойчивой электронной конфигурации. Устойчивой является электронная конфигурация с завершенным внешним электронным уровнем из (s2 + p6), т.е. из октета электронов.
Энергия электрона в основном определяется главным квантовым числом n и побочным квантовым числом l, поэтому сначала заполняются те подуровни, для которых сумма значений квантовых чисел n и l является наименьшей. Например, энергия электрона на подуровне 4s меньше, чем на подуровне 3d, так как в первом случае n + 1 = 4 + 0 = 4, а во втором n + l = 3 + 2 =5; на подуровне 5s (n + l = 5 + 0 = 5) энергия меньше, чем на 4d (n + l = 4 + 2 = 6); на 5р (n + l = 5 + 1 = 6) энергия меньше, чем на 4f (n + l = 4 + 3 = 7) и т.д.
Энергия электрона в основном определяется главным квантовым числом n и побочным квантовым числом l, поэтому сначала заполняются те подуровни, для которых сумма значений квантовых чисел n и l является наименьшей. Например, энергия электрона на подуровне 4s меньше, чем на подуровне 3d, так как в первом случае n + 1 = 4 + 0 = 4, а во втором n + l = 3 + 2 =5; на подуровне 5s (n + l = 5 + 0 = 5) энергия меньше, чем на 4d (n + l = 4 + 2 = 6); на 5р (n + l = 5 + 1 = 6) энергия меньше, чем на 4f (n + l = 4 + 3 = 7) и т.д.
По правилу Гунда при заполнении электронами одинаковых орбиталей электроны располагаются в первую очередь по одиночке на каждой орбитали, и лишь потом начинается заселение этих орбиталей вторыми электронами.
Принцип Паули:Никакие два электрона в одном атоме не могут характеризоваться одинаковым набором всех четырех квантовых чисел n, l, m, s.
Дата добавления: 2021-02-19; просмотров: 793;











