Кинетика процесса десульфурации металла
Как это ясно из сказанного выше, переход серы из металла в шлак обусловлен: 1) повышенной, по сравнению с металлом, растворимостью в шлаке таких атомных группировок, как Fe-S или Mn-S, и 2) образованием в шлаке сульфидов щелочноземельных (а иногда и щелочных) металлов, которые практически нерастворимы в металле. При этом существенную роль играет основность шлака. Кроме того, процесс десульфурации металла тесно связан с активностью растворенного в нем кислорода, а также активностью оксидов железа в шлаке.
Было также отмечено, что такие реакции как (CaO)+[FeS]=(CaS)+(FeO) или (CaO)+[S]=(CaS)+[O] не всегда и не полностью описывают процесс десульфурации металла. Поэтому для изучения истинной природы процесса очищения металла от серы, в дополнение к изучению равновесных значений условного равновесного коэффициента распределения серы между шлаком и металлом – (S)/[S], очень большое значение приобрело изучение кинетики процесса десульфурации. Для решения этой проблемы были привлечены такие современные методы исследования, как масс-спектрометрия, метод меченых атомов и др.
Истинный характер процесса десульфурации следует изучать с помощью представлений о шлаках, как об ионных растворах. О.А. Есин и др. [112] используя изотопы S35 и Fe59 изучали изменение во времени их концентраций в шлаке, контактирующем с расплавленным металлом, в который были введены эти изотопы. Характер изменения концентраций радиоактивных ионов железа и серы в кислых, нейтральных и основных шлаках позволил сделать вывод о том, что переход серы в кислые шлаки (например, состава 20,0 % СаО; 61 % SiO2; 17,4 % Al2O3) описывается процессом: Feж+[S]=(S2-)+ +(Fe2+) При контакте металла с нейтральными шлаками (44,1 % CaO; 31 % SiO2, 17,2 % Al2O3, 6 % MgO) этот процесс имеет лишь частичное значение и полной симбатности кривых изменения концентрации (S2-) и (Fе2+) не наблюдается. В случае основных шлаков (48,4 % CaO; 21,9 % SiO2; 15,2 % Al2O3; 12,7 % MgO) переход серы в шлак не сопровождается одновременным увеличением концентрации ионов железа. Это позволило заключить, что при наличии основных шлаков десульфурация описывается процессом: [S]+(O2-)=(S2-)+[O]. Аналогичные заключения можно сделать и на базе других многочисленных исследований. На рис. 28, 30 приведены данные о кинетике десульфурации насыщенного углеродом железа известково-глизоземистым шлаком [114]. Кривые изменения объема выделившейся оксида углерода и изменения концентрации серы в шлаке, вследствие десульфурации металла имеют совершенно аналогичный ход, который подтверждает уравнения.
Ряд других лабораторных и промышленных исследований – например, описанные в работе [117] опыты по десульфурации кислыми шлаками (рис. 32), свидетельствуют о справедливости предложенных О.А. Есиным [112] уравнений для описания процессов десульфурации шлаками различного характера (т.е. как кислыми, так и основными).
Кинетика десульфурации, как процесса имеющего в ряде случаев решающее для практики значение, исследовалась многими учеными. Задачи и условия протекания десульфурации в современных сталеплавильных процессах настолько различны, что лишь в самой общей форме можно назвать управляющие ими закономерности. В самом деле, обычная для мартеновского или конвертерного процесса задача понижения концентрации серы в металле с 0,03¸0,04 % до желаемых 0,02¸0,025 %, весьма отлична от часто встречающейся при производстве особо ответственных (главным образом, электросталей) задачи достижения концентраций серы в пределах 0,002¸0,005 %, а иногда даже 0,001 %.



Естественно, что весьма различны и привлекаемые для этого средства, к которым относятся:
1) обычные основные шлаки с различной основностью и концентрацией оксидов железа;
2) синтетические оксидные и оксидно-флюоридные расплавы и
3) твердые фазы, извлекающие серу – порошкообразная известь и даже плавленый оксид кальция, порошкообразный СаС2 и т.п.
Процессы десульфурации обычно завершают используя комплексные сплавы, содержащие щелочноземельные и редкоземельные элементы, природу и кинетику взаимодействия которых с серой целесообразно рассмотреть ниже.
Во всех перечисленных случаях процесс десульфурации состоит из следующих последовательно протекающих этапов:
1. Массоперенос атомов серы (а в отдельных случаях и атомов других элементов, сопровождающих десульфурацию: Fe, Mn и O) из объема расплавленного металла к поверхности его контакта с поглощающей серу средой (внутренний массоперенос).
2. Реакция на межфазной границе металл-фаза, извлекающая серу, или вообще перенос серы через эту границу ("адсорбционно-кинетический акт").
3. Массоперенос продуктов реакции, протекающей на границе металла и извлекающей серу фазы (S2-, Fe2+ и др.), от поверхности контакта в объем этой фазы.
В связи с этим задача изучения кинетики процесса десулъфурации заключается не только в определении изменения во времени концентрации серы в металле, но и в определении ведущего звена этого процесса. Многочисленные работы, посвященные этому вопросу, относятся к проблеме десульфурации чугунов, что объясняется не только практической важностью этой проблемы, но также и относительной простотой лабораторного эксперимента (высокая [S], относительно низкая температура, легкость выбора огнеупора для тигля и т.п.) [116-119].
В большинстве работ исследовалось влияние на кинетику процесса десульфурации таких факторов, как:
1. Исходная и "текущая" концентрации серы;
2. Состав металла (C, Si, Мn, иногда О);
3. Величина удельной поверхности контакта металла и шлака (или извлекающей твердой фазы);
4. Состав шлака и
5. Температура.
В общем виде справедливо уравнение:
–(d[S]/dt) (G/F)=k1[S]x–k2(S)y, (104)
где t - время;
G – вес металла;
F – поверхность его контакта с фазой, извлекающей серу;
x и у – величины, характеризующие порядок прямой и обратной реакций перехода серы из одной фазы в другую.
В тех случаях, когда ведущим звеном процесса является химическая реакция, протекающая на границе соприкасающихся фаз, и равны стехиометрическим коэффициентам в уравнении, описывающем этот процесс, т.е. они определяют порядок реакции.
В начале процесса десульфурации, когда (S)»0, уравнение (104) принимает вид: –(d[S] /dt)(G/F)=k1[S]* или, после интегрирования и разделения переменных
ln[S]нач–ln[S]t=–(k1t/Wм)t®0, (105)
где [S]нач и [S]t – концентрации серы в металле в начале процесса его десульфурации и в любое, но малое, время t (пока концентрации (S) еще малы);
W – объем металла, приходящийся на единицу поверхности его контакта со шлаком.
В лабораторных условиях в отдельных случаях удается так организовать процесс десульфурации, что его ведущим звеном является массоперенос серы в объеме жидкого металла. В этом случае – в соответствии с законами формальной кинетики – должно соблюдаться уравнение:
D[S]=[S]нач–[S]t=k 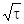 , (106)
, (106)
где k – константа, зависящая при данной температуре только от размерностей [S] и t.
Энергия активации для данного, очень редко встречающегося процесса десульфурации, до сих пор не определена с достаточной надежностью. Если скорость удаления серы из металла определяется внутренним массопереносом, это значит, что во всем объеме металла передача этого компонента определяется конвективными потоками в металле или перемешиванием его под влиянием тех или иных внешних сил. В этом случае наиболее медленным звеном является диффузионный перенос серы через неперемешиваемый поверхностный слой металла, т.е.:
V[S]=d[S]t/dt=D[S]([S]об–[S]пов /d)=(DS/d)[S], (107)
где V[S] – скорость десульфурации металла;
D[S] – коэффициент диффузии серы (для температуры, при которой определяется V[S]);
[S]об и [S]пов – концентрации серы на поверхностях контакта диффузионного неперемешиваемого слоя с объемом металла и со средой, извлекающей серу;
d – толщина неперемешиваемого слоя металла, зависящая от гидродинамики исследуемого расплава, и определяемая критериями Рейнольдса, Нуссельта и др.
Величину "d" определить весьма трудно, но интересно, что, если принимать ее в логически допустимых пределах (например, от 0,001 до 1 мм), то во всех случаях расчетное значение V[S] окажется гораздо выше наблюдаемой суммарной скорости удаления серы. Это заставляет сделать вывод о том, что в промышленных условиях "внутренний массоперенос" серы практически никогда не является ведущим звеном.
В ряде работ [111,118] определяли энергию активации процесса десульфурации с целью нахождения его ведущего звена. По данным различных исследователей она составляет 30-80 ккал/моль (126-З30 кДж/моль), т.e. очень велика для того, чтобы ведущим звеном можно было считать "внутренний массоперенос" серы или других компонентов, окисляющихся за счет поступающих ионов кислорода. Однако в работе [114] отмечен такой интересный факт, как ярко выраженная зависимость скорости десульфурации от концентрации в металле элементов, обладающих высоким сродством к кислороду. Последние по степени их влияния на скорость перехода серы из металла в шлак можно разместить в следующий ряд: Al, Ti, Mn, Si, C. Влияние этих элементов, вероятнее всего, проявляется именно благодаря их взаимодействию с кислородом, поступающим из шлака в металл, по реакции: [S]+O2–=[O]+S2- (для алюминия оно максимальное). В работе [119] приведены данные об ускорении десульфурации за счет перемешивания металла или шлака. На рис. 33 приведены результаты этих исследований, отчетливо показавшие положительное влияние интенсивности перемешивания. Однако результаты этнос экспериментов не могут быть полезными для решения теоретически очень важного вопроса о нахождении ведущего звена процесса десульфурации. Дело в том, что при перемешивании какой-либо одной из контактирующих фаз (металла или шлака)некоторая доля энергии неизбежно передается и контактирующим поверхностным слоям и в какой-то мере объему всей второй из фаз, содержащих серу.
Существенное ускорение процесса десулъфурации было показано [119] и при наложении электролитического потенциала на систему металл-основной шлак. Эти опыты показали электрохимический характер процесса десульфурации. Также показана и большая роль процессов, происходящих на границе контактирующих фаз.
Ряд исследователей [120] считает, что именно переход серы через границу металл-шлак, т.е. адсорбционно-химическое звено является ведущим во всем процессе десульфурации. Однако это заключение, основанное на результатах хорошо поставленных экспериментов с применением радиоактивных изотопов, очевидно, далеко не всегда справедливо. В ряде работ, посвященных исследованию обессеривания чугунов известью, содой, силикатными расплавами раз- личного состава хорошо установлено, что ввод веществ, значительно понижающих вязкость шлаков (CaF2, Na2O и др.) резко повышает скорость десульфурации [121].
Таким образом, в зависимости от условий протекания процесса десульфурации, его ведущим звеном может быть либо кинетика перехода серы через границу раздела металл-шлак, либо массоперенос ионов в объеме шлаковой фазы. Не исключены условия и совместного лимитирования скорости процесса десульфурации со стороны обоих этих этапов.
Дата добавления: 2016-11-26; просмотров: 2093;











