Термодинамика раскисления
Удаление из металла кислорода, т.e. раскисление металла осуществляется путем:
1. Понижения растворимости кислорода в металле за счет введения в его состав металлов, имеющих более высокое сродство к кислороду, чем железо (растворитель);
2. Облегчения выделения кислорода в газообразную фазу за счет связывания его с углеродом и извлечения образующейся оксида углерода в разреженную атмосферу (раскисления вакуумированием);
3. Экстрагирование кислорода, находящегося в металле в форме атомных группировок Fе-О или в виде уже сформировавшихся оксидных включений, в шлаковую фазу, обладающую высокой растворимостью по отношении к этим атомным группировкам и к включениям.
Некоторое теоретическое значение имеет обмен кислородом между твердой фазой (огнеупорами тиглей и т.п.) и жидким металлом.
Однако на практике он играет сколько-нибудь заметную роль лишь в отдельных частных случаях, например, при использовании очень сильных раскислителей или, наоборот, при производстве кипящих сталей.
Решающее значение, в особенности в наиболее распространенном первом варианте раскисления металла, имеет достижение благоприятных условий для по возможности более полного удаления образовавшихся при этом неметаллических включений и достижение такого химического состава и формы все же остающихся в металле включений, при которых они были бы наименее вредны, а иногда даже и полезны для служебных свойств металла.
Для создания научных основ раскисления стали прежде всего потребовалось разработать термодинамику этого сложнейшего процесса. Однако определение раскислительной способности того или иного элемента или влияния раскислителя на растворимость кислорода в сплаве Fe-R (где R – элемент-раскислитель) при данной температуре сплава представляет собой экспериментально очень трудноразрешимую задачу. Дело в том, что парциальные давления кислорода в газовой фазе, равновесной с расплавом Fe-R, неизмеримо малы и экспериментально очень трудно достижимы. Также ничтожно малы равновесные концентрации растворенного в расплаве кислорода.
Поэтому интересующий металлургов процесс "прямого" окисления элемента R
m[R]+n/2O2газ=RmOn
или
m[R]+n[O]=(RmOn)
приходится заменять другими процессами, которые позволяют вычислить[O] или равновесное 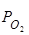 , но легче контролируются в процессе эксперимента.
, но легче контролируются в процессе эксперимента.
Поэтому для изучения термодинамики раскисления применяют следующие способы:
1. Равновесие сплава Fe-R с газовой смесью Н2+ малые количества Н2О. Парциальные давления 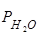 в функции от температуры и от /R/ довольно точно определимы. Поэтому экспериментально может быть найдена и Dg для реакции:
в функции от температуры и от /R/ довольно точно определимы. Поэтому экспериментально может быть найдена и Dg для реакции:
[R]+{H2O}=RO+{H2}, DgI
В свою очередь для водяного пара хорошо изучена реакция:
{H2O}=[O]+{H2}, DgII
Поэтому для исследуемой реакции раскисления имеем:
[R]+[O]=RO, DgS=DgI–DgII
и, следовательно,
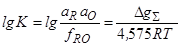
2. Равновесие сплава Fe-R с газовой смесью СО+ малые доли СО2.Оба метода оказались применимыми и достаточно точными только для определения раскислительной способности таких относительно слабых раскислителей, как С, Mn, V, Cr, Nb. Для определения раскислительной способности более сильных раскислителей применяются другие методы.
3. Плавка металла в тиглях из относительно нестабильных оксидов (например, кварцевых или алундовых), восстанавливаемых другими сильными раскислителями. При использовании кварца в качестве нестойкого материала для определения раскислительной способности элемента R, рассматриваются следующие реакции:
n/2[Si]+RmOn(тв,ж)=m[R]+n/2(SiO2)тв, DGI
n/2(SiO2)тв=n/2[Si]+n[O], DGII

в результате: RmOn(тв,ж) = m[R]+n[O], DGS = DGI – DGII
Чем выше раскислительная способность элемента R, тем труднее подобрать достаточно стойкий по отношению к нему материал тигля и тем меньше надежность даже самых точных определений величины /O/, т.к. в этом случае она несколько отлична от равновесной с RmOn определяется постепенным растворением материала тигля в сильно раскисленном металле. Основным недостатком этого метода определения раскислительной способности того или иного элемента является практическая невозможность надежной фиксации равновесия между исследуемым раскислителем и материалом тигля. Фактически к равновесию с раскислителем приближается лишь какой-то тонкий слой тигля, а весь остальной объем его при этом продолжает медленно нарушать это равновесие по мере диффузии элементов R и O в твердом материале тигля.
4. Наиболее надежным является метод электрохимического исследования процессов раскисления по величине электродвижущей силы (э.д.с.) гальванического элемента, состоящего из электрода сравнения (чаще всего смесь Mo-MoO2 или Cr-Cr2O3), "разделяющего’’ твердого электролита (обычно ZrO2, стабилизированный CaO или Y2О3, Нf2O3) и исследуемого расплава. Подбор и изготовление достаточно химически стойкого твердого электролита, обладающего ионной электропроводностью за счет кислорода, создаст благоприятные условия для наиболее надежного определения раскислительной способности элементов, в том числе и сильных раскислителей. Кроме того, этот метод позволяет экспериментальным путем непосредственно определить активность растворенного в металле кислорода, находящегося в равновесии с известной концентрацией (или известной активностью) введенного раскислителя.
При использовании любого из трех первых вышеприведенных методов существенным этапом исследования является определение концентрации кислорода, оставшегося в металле в равновесии с введенным раскислителем. Здесь возможны серьезные ошибки даже когда применяются самые совершенные анализаторы "на кислород", поскольку при этом определяется суммарное количество кислорода, находящегося в пробе металла как в растворенном виде, так и в форме продуктов взаимодействия раскислителя и кислорода металла, а также возможного взаимодействия металла с материалом тигля. Иногда, например при исследовании сильных раскислителей масса кислорода, содержащегося в виде этих включений соизмерима, а часто даже больше, чем масса кислорода, оставшегося в металле в растворе. Все это является причиной больших расхождений результатов исследований раскислительной способности, в особенности сильных раскислителей, например Al, Zr, редкоземельных и, в особенности щелочноземельных элементов, и качестве примера достаточно привести сводку данных о раскислительной способности Al, приведенную в работе [125].При aAl=1 константа равновесия KAl=[Al]2[O]3 при 1600 °С по данным различных авторов колеблется от 2,9×10-9 до 1×10-14. В связи с этим приводимые в литературе сведения об изменениях изобарно-изотермического потенциала при реакциях раскисления сильными раскислителями нельзя еще считать вполне точными и надежными.
При исследовании термодинамики раскисления стали одной из важнейших задач является определение влияния концентрации элемента-раскислителя на концентрацию и активность растворенного в металле кислорода, т.е. построение изотерм раскисления железа тем или иным раскислителем. Введение в расплав элемента-раскислителя (R) сопровождается двумя взаимно противоположными явлениями:
1) Понижением парциального давления кислорода в расплаве, следствием чего в соответствие с реакцией
1/2О2газ=[O]; 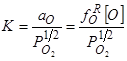 ,
,
является уменьшение [O], т.е. растворимости кислорода.
2) Снижение 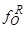 ,т.е. уменьшение активности кислорода в расплаве, что повышает растворимость этого элемента.
,т.е. уменьшение активности кислорода в расплаве, что повышает растворимость этого элемента.
Именно 2-я зависимость и является причиной отклонения экспериментальных результатов от математически требуемой линейной зависимости lg[O]–lg[R] в тех пределах концентраций /R/, в которых при каждой данной температуре формируется вполне определенный продукт окисления RmOn (см. рис. 36).
 |
Двойственное влияние раскислителей на активность и растворимость кислорода в металле является причиной появления экстремума на изотермах раскисления (рис. 36). Это означает, что при заданной температуре для каждого раскислителя имеется минимально достижимая равновесная концентрация кислорода [126-129].
Параметр взаимодействия кислорода по раскислителю 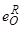 [32,33] определяется выражением:
[32,33] определяется выражением:
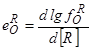 , (113)
, (113)
или при выражении концентраций [R]и [O] в молярных процентах
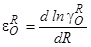
В дальнейшем нами будет использоваться первое из этих выражений.
Физико-химические исследования и анализ имеющихся в литературе математических зависимостей и экспериментальных результатов позволяет, после некоторых упрощений, определить оптимальную концентрацию того или иного раскислителя, при которой достигается минимальная для него концентрация кислорода, например, по формуле [125, 130, 131]:
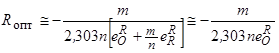 , (114)
, (114)
где Rопт – оптимальная концентрация раскислителя;
m и n – стехиометрические коэффициенты образуемого раскислителем оксида RmOn;
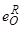 – параметр взаимодействия кислорода по раскислителю [32, 33].
– параметр взаимодействия кислорода по раскислителю [32, 33].
Вопросы, связанные с термодинамикой раскисления, многократно тщательно исследовались. Однако полученные результаты, в особенности в области применения сильных раскислителей, все-таки следует считать лишь приблизительными, хотя и достаточными для промышленного использования.
В дополнение к рис. 36 ниже в таблице 9 приведены константы равновесия процессов раскисления [132] и соответствующий график [128] на рисунке 37, из которых виден некоторый разброс экспериментальных результатов различных исследователей. Из приведенной таблицы 9 видно, что на графиках lgaО=f(lgR) изотермы раскисления (например, при t=1600 °С) показывают прямолинейную зависимость и в этом отношении они противоположны графикам, представленным на рис. 36 и 37.

Таблица 9 – Константы равновесия процессов раскисления железа некоторыми раскислителями при насыщении его образующимися оксидами
| Константа равновесия | Предельные концентрации раскислителя | Значения при 1600 °С | lgK |
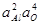
| < 1/млн Al | 1,1×10-15 | 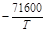 +23,28 +23,28
|
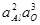
| > 1/млн Al | 4,3×10-14 | 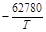 +20,17 +20,17
|
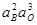
| – | 1,3×10-8 | |
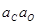
| 0,002 % C | 2,0×10-3 | 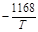 -2,07 -2,07
|
| при РСО=0,1 мПа | |||
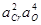
| > 3 % Cr | 4,0×10-6 | 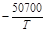 +21,70 +21,70
|
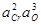
| > 3 % Cr | 1,1×10-4 | 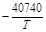 +11,78 +11,78
|
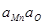
| > 1 % Mn | 5,1×10-3 | 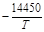 +6,43 +6,43
|
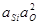
| > 20 1/млн Si | 2,2×10-5 | 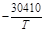 +11,59 +11,59
|
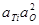
| < 0,3 % Ti | 2,8×10-6 | |
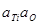
| > 5 % Ti | 1,9×10-3 | |
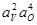
| < 0,1 % V | 8,3×10-4 | |
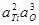
| > 0,3 % | 3,5×10-6 |
В современных условиях большое значение имеет одновременное раскисление несколькими раскислителями, так называемое "комплексное раскисление". Актуальность проблемы "комплексного раскисления" определяется:
1. В соответствии с существующими стандартами в большинстве марок стали предусматриваются определенные концентрации относительно слабых раскислителей (например Mn, Si, реже Сr и V) при окончательном раскислении сильными раскислителями (например, Аl). Таким образом, эти элементы принимают участие в комплексном раскислении, существенно влияя как на термодинамику, так и на кинетику этого процесса.
2. При производстве многих, в особенности сильных и очень сильных раскислителей, в частности содержащих щелочноземельные или редкоземельные элементы, чисто технологически в сплав необходимо вводить разбавляющие и облегчающие производство компоненты, например, кремний, и производить такие сплавы как ферросиликокальций и т.п.
3. Опыт восстановительного электропереплава некоторых видов природного сырья приводит к попаданию в производимый сплав не встречавшихся в нем ранее и малоизученных компонентов, например, Ва или Sr при производстве силикокальция.
Существенные преимущества комплексного раскисления заставляют остановиться на нем несколько подробней.
В работе [42] рассмотрен вопрос о том, каков должен быть состав комплексного раскислителя для того, чтобы он имел большую раскисляющую способность по сравнению с наиболее сильным раскислителем, входящим в его состав. Приведенные здесь теоретический анализ и экспериментальные результаты показали, что это достигается лишь в том случае, когда изобарно- изотермический потенциал процесса образования интерметаллического соединения между компонентами раскислителя (DG1) менее отрицателен, чем сумма изобарно-изотермических потенциалов раскисления маточного металла более слабым раскислителем, входящим в состав комплексного, (DG2) и образования растворов (или соединений) между продуктами раскисления обоими компонентами, входящими в состав комплексного раскислителя (DG3), т.е. должно быть соблюдено неравенство:
DG1>DG2+DG3 (115)
О величине DG1 определенное представление может дать параметр взаимодействия
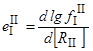
Величина DG2 может быть взята по таблице 10 или по рисунку (рис. 42). Что касается DG3, то ее лишь приближенно можно оценить по диаграмме состояния оксидов RImOn и RIIpOg.
Наиболее распространенные в практике сталеплавильного производства комплексные раскислители Al+Si, Mn+Al+Si, Si+Ca и другие имеют высокие отрицательные значения изобарно-изотермического потенциала образования растворов продуктов раскисления ими железа или даже свободную энергию формирования между ними прочных химических соединений (DG3).Активность кислорода, равновесная с вышеназванными комплексными раскислителями, при данной температуре всегда ниже, чем даже для наиболее сильного из входящих в его состав раскислителей при той же концентрации последнего. Это объясняется тем, что при образовании продуктом раскисления сильным раскислителем раствора или даже химического соединения с одновременно образующимися продуктами раскисления другими компонентами комплексного сплава его активность оказывается ниже единицы, т.е. ниже активности продукта раскисления одним сильным раскислителем. Равновесная с комплексным раскислителем а также суммарная концентрация кислорода в металле:
[O]S=[O]раст+[O]вкл,
также обычно ниже, чем для одного сильного раскислителя.
Однако основное преимущество комплексных сплавов, как раскислителей, т.е. сплавов, удовлетворяющих неравенству (114) заключается в формировании ими более легко и более полно удаляемых из металла неметаллических включений, а также менее вредных для служебных свойств металла тех включений, которые все-таки в металле остаются и не удаляются из него. Преимущества комплексных раскислителей особенно четко проявляются в кинетике процесса раскисления и очистки металла от продуктов раскисления.
Дата добавления: 2016-11-26; просмотров: 1908;











