Сведения об экологии. Связь химии с другими науками.
В свойствах смесей есть еще одна интересная закономерность: температура плавления смеси нескольких веществ всегда ниже, чем температура плавления каждого из чистых веществ по отдельности. Например, температура плавления чистой воды (в виде льда или снега) 0 оС. Если внести в лед примесь другого чистого вещества - поваренной соли, то лед начинает плавиться при более низких - минусовых температурах. Температура плавления зависит от соотношения льда и соли, скорости перемешивания и даже степени измельчения льда. Химик, умело смешав ровно 100 г измельченного льда и ровно 33 г поваренной соли, может получить температуру -21,3 оС. Разумеется, здесь дело не столько в механическом смешивании двух веществ, сколько в их взаимном растворении. Много энергии растворителя тратится на разрушение кристаллов соли и льда, что ведет к резкому понижению температуры смеси.

В этом опыте термометр, погруженный в смесь льда с солью, показывает -16 оС. В принципе такой способ позволяет достичь температуры ниже -20 оС.
Когда-то этим явлением пользовались для очистки улиц зимой от льда - посыпали тротуары и дороги солью, после чего даже на морозе лед таял, а загрязненная солью вода стекала в ливневую канализацию. Соленая вода на улицах портила обувь прохожих, заставляла быстрее ржаветь металл автомобилей, вредила зеленым насаждениям, попадала в реки и загрязняла их. В данном случае риск нанести ущерб природе и людям выше, чем выгода от экономии труда по уборке снега. Поэтому необходимо отказаться от такого использования законов природы для нужд человека. Соотношение риска и выгоды в разных сферах человеческой деятельности, в том числе и в химии, изучает специальная наука - экология.
Химия, физика, биология только на первый взгляд могут показаться далекими друг от друга науками. Хотя лаборатории физика, химика и биолога очень непохожи, все эти исследователи имеют дело с природными (естественными) объектами. Это отличает естественные науки от математики, истории, экономики и многих других наук, изучающих то, что создано не природой, а прежде всего самим человеком.
Близко к естественным наукам примыкает экология. Не следует думать, будто экология - это "хорошая" химия, в отличие от классической "плохой" химии, которая загрязняет окружающую среду. Нет "плохой" химии или "плохой" ядерной физики - есть научный и технический прогресс или его недостаток в какой-нибудь области деятельности. Задача эколога - использовать новые достижения естественных наук для того, чтобы при максимальной выгоде свести к минимуму риск нарушения среды обитания живых существ. Баланс "риск-выгода" является предметом изучения экологов.
Между естественными науками нет строгих границ. Например, мы уже познакомились с атомами нескольких видов. Открытие и изучение свойств новых видов атомов когда-то было принято считать задачей химиков. Однако получилось так, что из известных на сегодняшний день видов атомов часть открыта химиками, а часть - физиками. Это лишь один из многих примеров "открытых границ" между физикой и химией.
Жизнь является сложной цепью химических превращений. Все живые организмы поглощают из окружающей среды одни вещества и выделяют другие. Значит, серьезному биологу, врачу, ботанику, агроному, зоологу не обойтись без знания химии.
Позже мы убедимся в том, что нет совершенно точной границы между превращениями физическими и химическими. Природа едина, поэтому мы всегда должны помнить о том, что невозможно разобраться в устройстве окружающего нас мира, углубившись только в одну из областей человеческого знания.
ЗАДАЧИ К ГЛАВЕ 1.
1.10. Придумайте опыт, в котором можно было бы выяснить, не пробуя на язык, что в колбе находится раствор поваренной соли, а не чистая вода.
1.11. Одно из следующих выражений не имеет смысла. Найдите его: а) "молекула аспирина", б) "молекула воздуха", в)"молекула терпинеола", г) "молекула азота".
1.12. Среди перечисленных явлений только одно - химическое. Найдите его: а) сахар расплавили на огне, б) сахар растворили в воде, в) соль растворили в воде, г) сахар обуглили на огне, д) смешали соль и сахар.
1.13. Среди перечисленных веществ только одно можно назвать сложным веществом. Найдите его: а) раствор углекислого газа в воде, б) углекислый газ, в) кислород, г) раствор кислорода в воде, д) озон.
1.14. Азот растворили в воде под давлением. Назовите полученное физическое тело.
1.15. В параграфе 1.4 была изображена молекула лекарственного вещества аспирина C9H8O4. Ответьте на следующие вопросы:
а) Каким веществом является аспирин - простым или сложным?
** б) Аспирин, как и многие другие вещества, состоящие в основном из атомов углерода (обозначение атома углерода - символ "С"), сгорает в кислороде без остатка с образованием углекислого газа СО2 и воды Н2О. Если мысленно разобрать молекулу аспирина на атомы и добавить к ним некоторое количество атомов кислорода, то сколько молекул Н2О и СО2 получится из одной молекулы аспирина?
** в) Сколько молекул кислорода О2 потребуется для превращения одной молекулы аспирина в углекислый газ СО2 и воду Н2О?
г) Аспирин и кислород превращаются в углекислый газ и воду. Среди участников этого химического превращения найдите простое вещество, сложные вещества.
** д) Используя химические формулы, запишите химическое превращение аспирина и кислорода в углекислый газ СО2 и воду Н2О. Запись химической реакции должна выглядеть так:
aСxНyОz (аспирин), + bО2 = cСО2 + dН2О
где a, b, c, d, x, y, z - целые числа. Количество одинаковых атомов в левой и правой частях уравнения должно совпадать.
** е) Пока еще никому не удалось придумать, как из воды Н2О и углекислого газа СО2 сразу получить аспирин и кислород. Напишите эту очень нужную (но пока не изобретенную) реакцию с помощью химических формул.
 1.16. Нашего неудачливого исследователя из параграфа 1.1, который пытался погрузить натрий в воду, зовут Юх (от слов "юный химик"). Если бы в замечательной сказке Николая Носова "Приключения Незнайки и его друзей" был коротышка, который любил всё смешивать и смотреть, что получится, то его, вероятно, звали бы именно так. Правда, химию он знал пока не очень хорошо, но зато очень любил химические опыты. Однажды Юх нашел кусок какого-то металла и расплавил его на электрической печке. Сняв с печи щипцами тигель (это чашечка из глины или фарфора), в котором булькал расплавленный металл, Юх поставил его на деревянный стол и вышел за своим рабочим журналом, в который всегда старался аккуратно записывать результаты опытов. Когда через минуту он вернулся, то обнаружил, что стол горит, а на стенах комнаты оседает черная копоть. Не растерявшись, Юх вылил на стол ведро воды. Раздалось шипение, комната наполнилась паром, тигель треснул на несколько осколков, а бесформенный кусок металла упал на пол. Убирая комнату, Юх задумался над тем, какие явления он наблюдал и пришел к выводу, что происходили только физические явления. На самом деле он ошибся. Найдите в тексте задачи вещество (или вещества), которое (или которые) образовались в результате химического превращения.
1.16. Нашего неудачливого исследователя из параграфа 1.1, который пытался погрузить натрий в воду, зовут Юх (от слов "юный химик"). Если бы в замечательной сказке Николая Носова "Приключения Незнайки и его друзей" был коротышка, который любил всё смешивать и смотреть, что получится, то его, вероятно, звали бы именно так. Правда, химию он знал пока не очень хорошо, но зато очень любил химические опыты. Однажды Юх нашел кусок какого-то металла и расплавил его на электрической печке. Сняв с печи щипцами тигель (это чашечка из глины или фарфора), в котором булькал расплавленный металл, Юх поставил его на деревянный стол и вышел за своим рабочим журналом, в который всегда старался аккуратно записывать результаты опытов. Когда через минуту он вернулся, то обнаружил, что стол горит, а на стенах комнаты оседает черная копоть. Не растерявшись, Юх вылил на стол ведро воды. Раздалось шипение, комната наполнилась паром, тигель треснул на несколько осколков, а бесформенный кусок металла упал на пол. Убирая комнату, Юх задумался над тем, какие явления он наблюдал и пришел к выводу, что происходили только физические явления. На самом деле он ошибся. Найдите в тексте задачи вещество (или вещества), которое (или которые) образовались в результате химического превращения.
Глава 2. Строение атома. §2.1 Атомы.
Атомы не сразу вошли в научный обиход, хотя само слово "атом" появилось еще в сочинениях древнегреческих философов. В переводе с греческого оно означает "неделимый". Философы объясняли окружающий мир доступными средствами, среди которых не было современных приборов, но были наблюдательность и логика.
Чисто логическим путем можно прийти к выводу, что дробление вещества не может происходить бесконечно. В конце концов должна остаться некая мельчайшая и неделимая крупинка вещества или атом вещества. Если бы таких неделимых крупинок не оставалось, то любую вещь можно было бы уничтожить до конца. А раз так, то новые вещи (и даже животные, растения) создавались бы из ничего. По мнению древнегреческих философов Левкиппа и Демокрита, это противоречило бы здравому смыслу.
О том, каким образом атомы соединяются в более крупные физические тела, люди того времени не имели представления. Было много и других неясностей, поэтому учение об атомах практически не развивались долгие два тысячелетия. Но постепенно накапливалось все больше и больше фактов, которые в конце концов привели к тем представлениям, с которыми вы уже коротко познакомились в первой главе. Строение веществ начали описывать с помощью молекул, составленных из атомов одного или нескольких видов.
В предыдущей главе было показано устройство молекул некоторых простых и сложных веществ. Эти очень разные по своим свойствам вещества состоят из молекул, "построенных" из атомов только пяти видов. Но атомы взяты в разных количествах и соединены по-разному. Чем отличаются атомы разных видов друг от друга? Почему атомы в этих молекулах соединились именно так, а не иначе? Почему атомы азота и кислорода соединились по два, но атом аргона остается в одиночестве? Можно ли в молекуле углекислого газа соединить тот же набор атомов по-иному? Как атомы "прикрепляются" друг к другу?
Ответы на эти и многие другие вопросы, которые встретятся нам дальше, невозможно получить, не разобравшись в устройстве атома.
Дело в том, что знание внутреннего устройства атома позволяет объяснять и даже предсказывать многочисленные свойства окружающих нас веществ. Конечно, выяснить строение такого необычного, невидимого глазу объекта было чрезвычайно трудно. Однако изобретательный человеческий ум справился даже с такой сверхтрудной задачей. О том, как это удалось осуществить, коротко рассказывается в следующем параграфе (а более подробно - в параграфе 2.7).
Те из вас, кому не терпится узнать - что же именно удалось выяснить в строении атома, могут перейти к параграфу 2.3. Но если вам интересно разобраться в том, как это происходило, мы советуем сначала прочитать §2.2.
** §2.2 Электроны и протоны. Модели атома.
Атомы состоят из еще более мелких частиц, которые были открыты в разное время разными исследователями. Самой первой из таких частиц оказался электрон, несущий единичный электрический заряд.
Электрон получил свое нынешнее название только в самом конце прошлого века, а до этого физики только предполагали, что существует некий "атом электричества", с помощью которого по проводам передается электрический ток.
В 1853 году французский исследователь А. Массон решил попробовать пропускать электрические разряды (искры) через стеклянную трубку, из которой откачан воздух. Впоследствии с помощью этого несложного устройства англичанин Вильям Крукс провел множество опытов, и с тех пор такие трубки называют круксовыми (их прямые "потомки" - редко встречающиеся теперь электронно-лучевые телевизоры и мониторы).
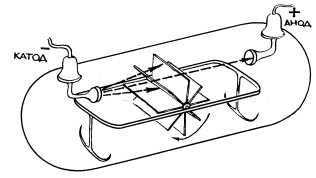
Рис. 2-1. Вращение вертушки с лопастями под действием катодных лучей в трубке Крукса. Этот опыт позволял предположить, что катодные лучи больше похожи не на обычный свет, а на поток микроскопических частиц, имеющих массу.
Что же удалось выяснить с помощью круксовых трубок? Они служили источником необычных лучей, которые распространялисьотрицательно заряженным электродом - катодом. Эти лучи получили название катодных. Описывая катодные лучи, Крукс отмечал такие их свойства:
- они вызывают свечение некоторых веществ, нанесенных на внутреннюю поверхность трубки;
- они обладают кинетической энергией и способны передавать механическое движение вертушке с лопастями (рис. 2-1);
- они отклоняются магнитным полем;
- они отрицательно заряжены, потому что движутся по направлению к положительному полюсу трубки.
В 1897 году английский физик Дж. Дж. Томсон сконструировал похожую трубку, с помощью которой можно было измерять отклонение катодных лучей в электрическом поле (рис.2-2).
Напряжение, подаваемое на пластины 4 и 5, между которыми проходили катодные лучи, можно было уменьшать или увеличивать. Чем выше было напряжение на пластинах 4 и 5, тем сильнее отклонялся от прямолинейной траектории поток катодных лучей.
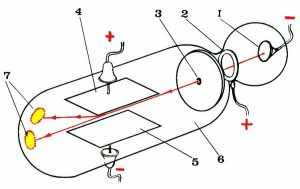
Рис. 2-2. Прибор Томсона для измерения отклонения катодных лучей под действием электрического поля. 1 - отрицательно заряженный электрод (катод), 2 - положительно заряженный электрод, 3 - отверстие, 4 и 5 - пластины электродов для отклонения катодных лучей, 6 - часть трубки, покрытая изнутри слоем вещества, светящимся под действием катодных лучей, 7 - светящееся пятно.
Впоследствии этот эксперимент помог установить массу и заряд частиц, из которых состоят катодные лучи: ведь чем меньше масса и чем больше заряд частицы, тем легче отклонить ее от прямолинейной траектории с помощью электрического поля. Правда, для этого потребовались дополнительные эксперименты, но в 1909 году цель была достигнута. Электрический заряд таинственных "катодных" частиц, выраженный в кулонах, оказался величиной чрезвычайно малой, поэтому для удобства физики и химики чаще пользуются другой шкалой, в которой величина этого "элементарного" заряда принята за единицу.
Описанные Томсоном отрицательно заряженные частицы, несущие наименьший электрический заряд, получили название электронов.
Позже в аналогичном приборе удалось наблюдать поток положительно заряженных частиц, которые стали называть протонами. Масса протона оказалась почти в 2000 раз больше массы электрона, а его заряд, как выяснилось, равен заряду электрона, но со знаком "плюс".
Таким образом, в распоряжении физиков появились первые "строительные детали", с помощью которых уже можно было попытаться построить те или иные модели атомов.
Томсон предположил, что атомы состоят из положительно заряженной сферы, в которую вкраплены электроны (рис. 2-3а). Эта модель атома получила среди ученых прозвище "сливовый пудинг", хотя не менее похожа и на булочку с изюмом (где "изюминки" - это электроны), или на "арбуз" с "семечками" - электронами.
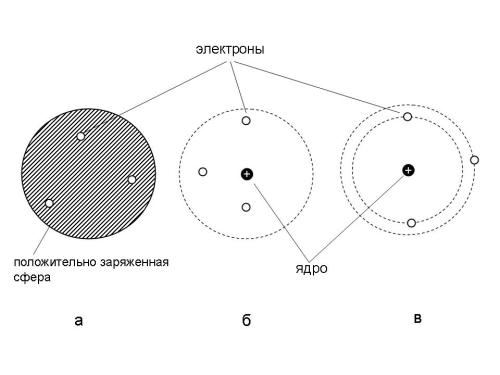
Рис. 2-3. Модели атома: а) Томсона (“сливовый пудинг”), б) Резерфорда, в) планетарная модель Бора.
В 1910 году английский физик Эрнст Резерфорд со своими учениками Гейгером и Марсденом провели эксперимент, который дал поразительные результаты, необъяснимые с точки зрения модели Томсона. В то время уже была открыта радиоактивность, о которой в наше время знают даже школьники начальных классов. Радиоактивные вещества способны испускать не только лучи высокой энергии, но и частицы высокой энергии, которые способны проникать сквозь многие предметы. Такие частицы называются альфа-частицами.
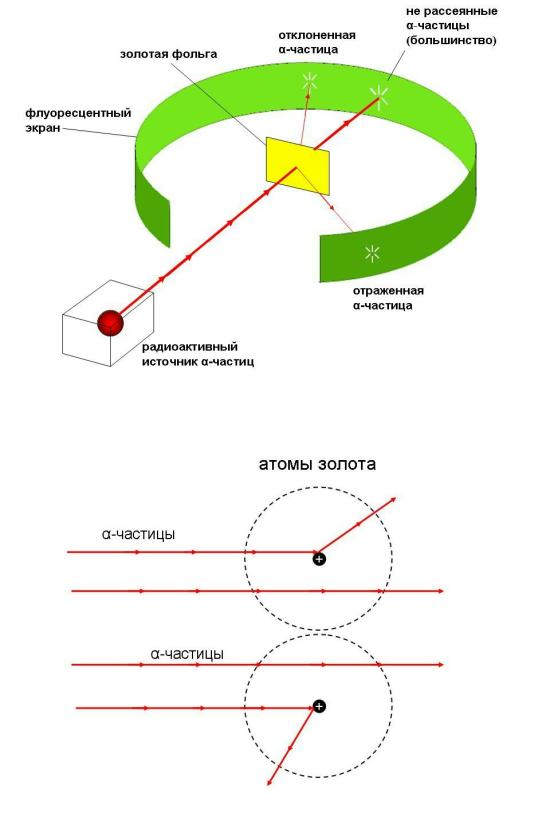
Рис. 2-4. Опыт Э.Резерфорда. Поток альфа-частиц проникает сквозь тонкую золотую фольгу толщиной приблизительно 10000 атомов. Пройдя сквозь золото, альфа-частицы вызывают вспышку при ударе об экран. По вспышкам на экране можно видеть отклонения части альфа-частиц от прямолинейной траектории.
В опыте Резерфорда поток альфа-частиц направлялся на тонкую золотую фольгу, а затем становился видимым на специальном экране со светящимся покрытием (рис 2-4).
Обнаружилось, что не все альфа-частицы проходят фольгу насквозь по прямой траектории. Некоторая их часть заметно отклонялась в сторону и даже отражалась от тонкого листа золотой фольги, как снаряд от брони! Это могло означать только одно: атомы золота не сплошные, а состоят из "разреженных" пустот (сквозь которые альфа-частицы проходят беспрепятственно) и очень плотных областей, от которых альфа-частицы отскакивают, как мячик.
Резерфорд предположил, что атом золота состоит из плотного, положительно заряженного ядра, в котором сосредоточена практически вся масса атома, и окружающих это ядро электронов (рис. 2-3б). Электроны вращаются вокруг ядра, образуя разреженный "электронный рой". Альфа-частицы относительно легко проходят сквозь разреженную область, занимаемую электронами и отражаются (или отклоняются в сторону) при столкновении с плотным ядром атома. По соотношению отклоненных и не отклоненных альфа-частиц удалось рассчитать, что размеры ядра атома золота примерно в 100000 раз меньше внешних границ атома, которыми он соприкасается с другими атомами!
Модель Резерфорда объясняла результаты эксперимента с альфа-частицами, но задавала физикам и химикам еще больше вопросов, чем было раньше. Почему при движении заряженного электрона около заряженного ядра не выделяется энергия? Как атомы "прикрепляются" друг к другу? Почему электроны не падают на ядро? Каким образом физические тела, состоящие из атомов, при нагревании испускают свет?
Эти вопросы частично прояснились только после того, как датский физик Н.Бор предложил модель атома, похожую на модель Резерфорда, но с тем отличием, что электроны располагались вокруг ядра на строго определенных, постоянных орбитах (рис. 2-3в). Эта модель напоминает устройство солнечной системы, где электроны вращаются вокруг ядра так же, как планеты вокруг Солнца.
Когда вещество нагревают, электроны поглощают энергию и переходят на более удаленные от ядра постоянные орбиты, а затем возвращаются на прежнее место, выделяя энергию строго отмеренными "порциями" (в виде света). Такая “порция” энергии (ее называют квантом света) в точности равна разнице между энергиями электрона на более высокой и менее высокой орбитах.
Изучая испускаемый нагретыми телами свет, можно выяснить, сколько постоянных электронных орбит существует в атоме и даже установить довольно сложное внутреннее устройство этих орбит (о том, как это было сделано, более подробно рассказывается в параграфе 2.7).
Результаты огромного числа экспериментов и усилия физиков-теоретиков позволили получить довольно подробную информацию об атомах. О том, какая картина внутреннего устройства атома открылась исследователям, рассказывается в следующих параграфах этой главы.
Дата добавления: 2016-11-04; просмотров: 2502;











