Размножение Вирулентного фага. Литический цикл
Размножение вируса в клетке-хозяине — весьма сложный процесс. Отдельные этапы этого процесса — от заражения клетки-хозяина до освобождения зрелых вирусных частиц, способных в свою очередь произвести заражение — довольно хорошо изучены с биохимической, генетической и морфологической стороны на примере фагов Т-серии (фаги Т2, Т4, ТО). Благоприятной предпосылкой для таких исследований явилось то обстоятельство, что в фаговой ДНК вместо цитозина содержится 5-оксиметшщитозин, а потому ее синтез легко проследить по появлению этого основания. Можно получить мутанты фага, у которых та или иная стадия процесса размножения блокирована или же протекает только в определенных условиях. Опыты с такими мутантами позволяют установить, как происходит в клетке-хозяине морфологическое развитие (морфопоэз) фага, т. е. в какой временной последовательности синтезируются и соединяются субъединицы фаговых частиц.
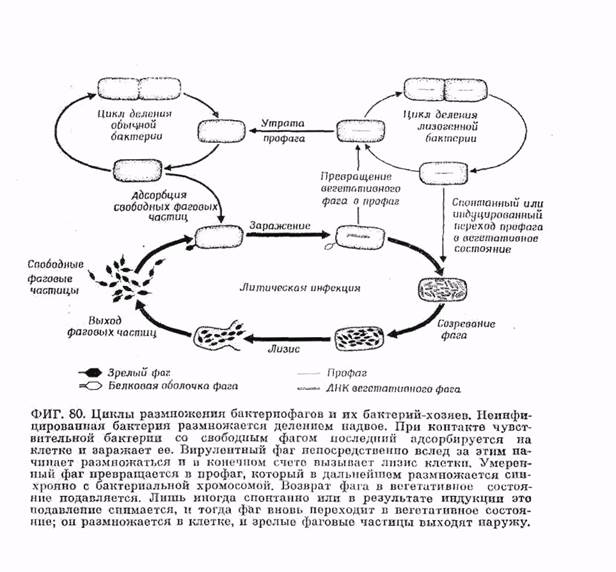
Подобно другим вирусам, фаги неподвижны. При смешивании суспензии свободных фагов с суспензией бактерий фаговые частицы в результате случайных столкновений с клетками прикрепляются к поверхности этих последних (адсорбция) и вводят в клетку свою ДНК (инъекция). После некоторого периода, на протяжении которого происходят процессы синтеза и созревания, клетки лизируются и новообразованные фаговые частицы выходят наружу.
Адсорбция.Не всякий фаг адсорбируется на всякой бактерии. Специфичность фага в отношении хозяина определяется специфичностью адсорбции. Последняя зависит от рецепторов, имеющихсяв клеточной стенке; рецепторы для одних фагов
содержатся в липопротеидном слое, для других — в липополисахаридном. Устойчивость некоторых бактерий к фагам зависит, вероятно, оттого, что в их клеточной стенке рецепторные вещества вообще отсутствуют. При избытке фага на одной клетке может адсорбироваться 200...300 фаговых частиц.
Внутриклеточное развитие фага. За адсорбцией следует инъекция, введение ДНК в клетку. У фага Т2 при этом базальная пластинка фиксируется на клетке, чехол отростка сокращается и чполый стержень (благодаря этому сокращению) входит в клетку. Опыты с фагом, у которого нуклеиновая кислота и белок несли разную метку (соответственно Р и S), показали, что в клетку попадает только нуклеиновая кислота, а белковая оболочка остается снаружи. Если отделить эту оболочку от зараженной клетки, размножение фага не нарушится. Во время так называемого скрытого периода (эклипс), продолжающегося у Escherichia coli в среднем 25 мин, в искусственно разрушенных бактериальных клетках не удается обнаружить фага. Фаговая ДНК, прежде всего, вызывает полную перестройку обмена веществ инфицированной клетки (фиг. 77). Тотчас же после заражения прекращается синтез бактериальной ДНК. Через несколько минут прекращается также синтез бактериальной РНК и бактериального белка, хотя общее содержание белка продолжает непрерывно увеличиваться. Затем синтез ДНК возобновляется, причем с повышенной скоростью. Сначала Фаговая ДНК образуется за счет распавшейся бактериальной. Эту перестройку и последующее новообразование фаговой ДНК можно количественно проследить по увеличению содержания 5-оксиметил-цитозипа — основания, специфичного для ДНК некоторых Т-фагов. Необходимые для синтеза фаговой ДНК ферменты образуются вскоре после заражения. Это так называемые «ранние белки». К «поздним белкам» относятся белки оболочки фага и фаговый лизоцим, или эндолизин; «поздние белки» образуются лишь во второй половине скрытого периода.
Заключительный процесс — созревание — состоит в соединении фаговой ДНК с белком оболочки и образовании зрелых инфекционных фаговых частиц. Созревание Лизогенные бактерии иммунные к заражению теми фагами, которые присутствуют в них в виде профага. Обеспечиваемый профагами иммунитет основывается не на отсутствии адсорбции (как при устойчивости к вирулентным фагам), а на образовании
особого цитоплазматического ропрессорного вещества, препятствующего размножению легетатипного фага. Это же ропрессорное вещество препятствует возврату профага is вегетативное состояние и подавляет синтез фаговых белков. Возникновение лизогенного состояния связано; таким образом, с образованием репрессора.
Спонтанно, без воздействия извне, лизогенные бактерии лизируются редко. Однако целый ряд факторов (ультрафиолетовые лучи и другие мутагенные агенты) может индуцировать в каждой клетке развитие профага, ведущее к образованию и выделению инфекционного фага. Успех такой индукции зависит от генетической конституции профага, физиологического состояния хозяина и условий культивирования. Индукция явно основывается па устранении или инактивации имеющихся молекул репрессора. Существуют мутанты умеренных фагов, вызывающие в клетке образование термолабильного репрессора. В этом случае для того, чтобы индуцировать лизис бактерий, достаточно просто повысить температуру до 44° С. Агенты, под действием которых происходит индукция,
по-видимому, вызывают накопление в клетке какого-то индуктора, инактивирующего репрессор.
Умеренные фаги могут также переходить в вирулентное состояние в результате мутации. Мутанты бывают двух типов. Одни мутанты оказываются устойчивыми к репрессору фага (они, поэтому могут размножаться и в лизогенных клетках, иммунных к обычным гомологичным фагам); другие мутанты утратили саму способность вызывать в клетке синтез репрессора. Этим, однако, дело не исчерпывается; вирулентные мутанты умеренных фагов отличаются от обычных вирулентных фагов по целому ряду физиологических признаков.
Интеграция и индукция фага К. Изучение фага X, лизогенного для Escherichia coli К 12, позволило установить, каким образом профаг связан с бактериальной хромосомой. Лизогенизация этим
фагом может служить примером жизненного цикла умеренного бактериофага. Длина хромосомы фага А, составляет всего около 2% длины бактериальной хромосомы. В свободных фаговых частицах ДНК присутствует в виде линейной двойной цепи. После инъекции в клетку-хозяина двойная цепь может замкнуться в кольцо.
В лизогенных клетках профаг прочно связан с хромосомой хозяина. При конъюгации клеток профаг вместе с хромосомой хозяина переносится из клетки-донора в клетку-реципиент. Генетические эксперименты показывают, что фаг X присоединен к хромосоме хозяина в совершенно определенном участке — между галактозным и биотиновым локусами. Соединение осуществляется па хромосоме или внутри нее. Сначала считалось, что ДНК профага только прикрепляется к хромосоме бактерии в этом участке. Однако в результате составления генетических карт фага, а также из опытов по рекомбинации стало ясно, что Фаговая ДНК при лизо^генизации не просто прикрепляется к бактериальной ДНК, а включается в нее. Такое включение профага {интеграция) происходит, очевидно, тем же путем, что и обмен ДНК при генетической рекомбинации, т. е. через разрыв и перекрестное воссоединение (фиг. 81). Поскольку Фаговая ДНК прикрепляется к бактериальной всегда в совершенно определенном месте, следует заключить, что у этих двух нуклеиновых кислот имеются гомологичные отрезки и что именно здесь происходит сначала наложение, а затем разрыв и воссоединение. Можно думать, что последовательности оснований фаговой и бактериальной ДНК в этих участках комплементарны.
В интегрированном состоянии Фаговая ДНК реплицируется вместе с бактериальной и подчиняется тем же регуляторным воздействиям, что и удвоение бактериальных хромосом. Информация, содержащаяся в фаговой ДНК, в это время выражения не находит.
Только в результате перехода профага в вегетативное состояние устанавливается автономия фаговой ДНК и начинается размножение фага. Этот обратный переход может происходить спонтанно или в результате индукции (например, при УФ-облучении). Отделение фаговой ДНК от бактериальной происходит, вероятно, путем, обратным включению, т. е. через образование петли ДНК и наложение гомологичных отрезков с последующим разрывом и новым замыканием кольца. Как только профаг в результате этого отделения перейдет в вегетативное состояние, он восстанавливает свою автономность; начиная с этого момента он перестает подчиняться репрессии и теперь уже размножается в бактериальной клетке как вирулентный фаг. Этот процесс приводит к лизису бактерий и высвобождению фага. Явление лизогении позволяет сделать вывод о существовании близкого родства между бактериями и бактериофагами. В основе его лежит, в конечном счете, довольно сильно выраженная гомологичность фаговой и бактериальной ДНК. Вирулентные фаги могут рассматриваться под этим углом зоения как продукт дальнейшего развития: они утратили гомологичность в отношении бактериальной ДНК и поэтому не могут более включаться в бактериальную хромосому; именно вследствие этого они и оказываются полностью автономными. На примере лизогенных бактерий видно, что многие вирусы могут быть самым тесным образом связаны с генетическим материалом клетки-хозяина и могут на протяжении многих поколений реплицироваться совместно с ним, ничем не обнаруживая своего присутствия.
Дата добавления: 2021-02-19; просмотров: 534;











