Аммиачный циклический метод
В этом случае в качестве основного реагента применяют аммиак, который, взаимодействуя в водном растворе с сернистым ангидридом, образует сульфит и бисульфит аммония:
SO2 + 2NH3 + H2O = (NH4)2 SO3; (23.4)
(NH4)2 SO3+SO2 + H2O = 2NH4HSO3. (23.5)
При нагревании {особенно под вакуумом) бисульфит аммония переходит в сульфит с выделением SO2:
2NH4HSO3 → (NH4)2SO3 + SO2 + H2O. (23.6)
Полученный сульфит аммония направляют для дальнейшего участия в процессе, а концентрированный SO2 используют как товарную продукцию.
Ввиду того что абсорбция SO2 аммиаком существенно интенсифицируется с понижением температуры, предварительно очищенные от пыли газы подвергают охлаждению в форсуночном скруббере с замкнутой циркуляцией охлаждающей воды (рис. 23.6).
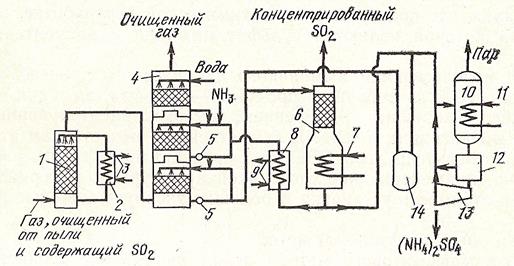
Рис. 23.6. Схема циклического аммиачного метода очистки газа от SO2: 1 — насадочный скруббер для охлаждения газа; 2 — охладитель жидкости, охлаждающей скруббер; 3 — подвод и отвод охлаждающей воды; 4 — трехступенчатый абсорбер для поглощения SO2; 5 — циркуляционные насосы; 6 — десорбер SO2; 7 — паровой обогрев десорбера; 8 — охладитель регенерированного раствора; 9 — подвод и отвод охлаждающей воды; 10 — выпарной аппарат; 11 — паровой обогрев; 12 — кристаллизатор; 13 — центрифуга; 14 — автоклав.
После охлаждения в скруббере, снабженном охладителем воды, газы поступают в трехступенчатый абсорбер, из которого выходят очищенными. Нижние ступени абсорбера орошаются раствором по замкнутой циркуляционной системе. Верхняя ступень, орошение которой производят чистой водой, служит для поглощения выделяющегося аммиака, подмешивающегося к очищаемому газу. На орошение второй ступени поступают вода, поглотившая аммиак на верхней ступени, и раствор восстановленного из десорбера сульфита аммония. В контур нижней ступени поступает раствор из контура второй ступени. Прореагировавший сорбент из нижнего контура орошения подают в десорбер, где за счет нагрева паром происходит восстановление бисульфита в сульфит по реакции (23.6). После охлаждения в поверхностном охладителе сульфит направляют снова в абсорбер. Концентрированный SO2, выделяющийся в десорбере, может быть использован для получения серной кислоты. Сульфит аммония может взаимодействовать с растворенным кислородом, образуя сульфат:
2 (NH4)2SO2 + O2 = 2 (NH4)2 SO4. (23.7)
Реакция образования сульфата нежелательна, так как осложняет процесс очистки.
Для выделения образующегося по уравнению (23.7) сульфата аммония, часть регенерированного раствора из десорбера направляют в выпарной аппарат, обогреваемый острым паром, а затем в кристаллизатор, где при охлаждении раствора выпадают кристаллы сульфата аммония, отделяемые на центрифуге от раствора, направляемого обратно в абсорбер. Кроме сульфата аммония, в поглотительном растворе образуется тиосульфат, накопление которого в цикле нежелательно. В этом случае часть раствора из цикла орошения нижней ступени направляют в автоклав, где подвергают термохимической переработке, продуктами которой являются сульфат аммония и элементарная сера.
При использовании аммиачного циклического процесса образуются ценные побочные продукты — сульфат аммония, являющийся хорошим удобрением, высококонцентрированный сернистый ангидрид и сера. К существенным недостаткам этого метода относятся: необходимость предварительного охлаждения газа, применение кислотостойкой арматуры и материалов, высокая стоимость установки и большие эксплуатационные расходы.
Дата добавления: 2021-07-22; просмотров: 916;











