Ядерная модель атома.
Резерфорд на основании опытов по рассеянию альфа-частиц на металлической фольге (1909-10 гг.) предложил ядерную (планетарную) модель атома. Атом представляет собой очень маленькое ядро, в котором сосредоточена почти вся масса атома, а вокруг ядра вращаются электроны подобно планетам солнечной системы. Эта модель оказалась несостоятельной, она не могла объяснить, почему спектры излучения газов состоят из отдельных линий, а не являются сплошными. Электроны, обладающие ускорением, должны непрерывно излучать электромагнитные волны, терять энергию и, в конце концов, упасть на ядро. Однако атомы являются устойчивыми системами.
В 1913 г Бор дополнил модель Резерфорда, выдвинув принципиально новые предположения (постулаты).
Постулаты Бора:
| В атомах существуют особые стационарные орбиты, на которых электрон может двигаться сколь угодно долго. | Целые числа 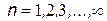 - номера орбит - получили впоследствии название квантовых чисел.
При n = 1 - номера орбит - получили впоследствии название квантовых чисел.
При n = 1 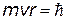 . Т.о. . Т.о. 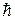 представляет собой минимальный момент импульса или минимальный квант действия представляет собой минимальный момент импульса или минимальный квант действия
| |
Момент количества движения (момент импульса) электрона на таких орбитах
равен:
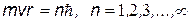
| ||
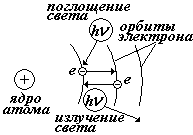
При переходе электрона с одной стационарной орбиты на другую происходит излучение (или поглощение) кванта энергии.
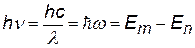 Е – энергия электрона на орбите
Е – энергия электрона на орбите
| 
|
Теория Бора может быть названа полуклассической, полуквантовой. В этой теории движение электрона на орбите описывалось классическими законами (формулы – см. дальше). Вместе с тем, теория приводила к тому, что скорость, радиус орбиты, энергия электрона не могут иметь любые значения, а квантуются, т.е. могут принимать только дискретные (отдельные) значения.
Теория Бора хорошо описывала закономерности в спектре атома водорода и водородоподобных атомов.(Водородоподобными атомами называют атомы (или ионы) у которых на последней орбите имеется только один электрон). Однако, для атома гелия (Z = 2) и других элементов теория Бора не давала совпадения с опытом.
Дата добавления: 2021-02-19; просмотров: 528;











