Строение и свойства аминогруппы.
Аминокислоты проявляют свойства оснований за счет аминогруппы и свойства кислот за счет карбоксильной группы, т.е. являются амфотернымисоединениями. В аминокислотах как гетерофункциональных соединениях можно выделить следующие реакционные центры: карбоксильная группа (электрофильный), аминогруппа (нуклеофильный) и радикал.
Вопрос 2. Аминокислоты: строение, изомерия и классификация.
Аминокислоты – органические бифункциональные соединения, в состав которых входят карбоксильные группа –СООН и аминогруппа –NH2.
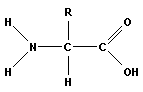
Другими словами, аминокислоты – органические кислоты, молекулы которых содержат одну или несколько аминогрупп (NH2–группы). Являются основными структурными элементами белков. Аминокислоты – строительные блоки, из которых строятся белковые структуры, мышечные волокна, например. Организм использует их для собственного роста, восстановления, укрепления и выработки различных гормонов, антител и ферментов. Помимо 20 наиболее распространенных аминокислот, входящих в состав белков, известно свыше 150 других, которые встречаются в различных клетках и тканях либо в свободном, либо в связанном виде, но никогда не встречаются в составе белков.
Аминокислоты подразделяются на незаменимые(валин, лейцин, изолейцин, треонин, метионин, фенилаланин, триптофан, лизин, гистидин). Незаменимые аминокислоты не синтезируются в организме человека, но необходимы для нормальной жизнедеятельности. Они должны поступать в организм с пищей. При недостатке незаменимых аминокислот задерживается рост и развитие организма. Оптимальное содержание незаменимых аминокислот в пищевом белке зависит от возраста, пола и профессии человека, а также от других причин. Белки пищи в организме человека расщепляются до аминокислот.
Таблица 1
α-Аминокислоты общей формулы 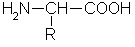
| Аминокислота | Обозначение | -R | Молекулярная формула |
| Глицин | Gly(G) | -H | C2H5NO2 |
| Аланин | Ala(A) | -CH3 | C3H7NO2 |
| Валин | Val(V) | -CH(CH3)2 | C5H11NO2 |
| Лейцин | Leu(L) | -CH2-CH(CH3)2 | C6H13NO2 |
| Изолейцин | Ile(I) | -CH(CH3)-C2H5 | C7H15NO2 |
| Цистеин | Cys(C) | -CH2-SH | C3H7SNO2 |
| Метионин | Met(M) | -CH2-CH2-S-CH3 | C5H11SNO2 |
| Серин | Ser(S) | -CH2-OH | C3H7NO3 |
| Треонин | Thr(t) | -CH(OH)-CH3 | C4H9NO3 |
| Фенилаланин | Phe(F) | -CH2-C6H5 | C9H11NO2 |
| Тирозин | Tyr(Y) | 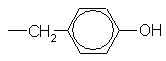
| C9H11NO3 |
| Триптофан | Trp(W) | 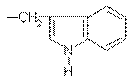
| C11H12N2O2 |
| Аспарагиновая кислота | Asp(D) | -CH2COOH | C4H7NO4 |
| Глутаминовая кислота | Glu(E) | -CH2-CH2-COOH | C5H9NO4 |
| Аспарагин | Asn(N) | -CH2-CO-NH2 | C4H8N2O3 |
| Глутамин | Gln(Q) | -CH2-CH2-CO-NH2 | C5H10N2O3 |
| Гистидин | His(H) | 
| C6H9N3O2 |
| Лизин | Lys(K) | -(CH2)4-NH2 | C6H14N2O2 |
Аргинин
 Пролин
Пролин
| Arg(R) Pro | 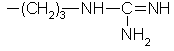
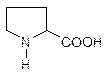
| С5Н9NO2 |
Определенная часть аминокислот, в свою очередь, расщепляется до органических кетокислот, из которых в организме вновь синтезируются новые аминокислоты, а затем белки. Отдельно стоят так называемые две "полузаменимые" аминокислоты: цистин (цистеин) и тирозин. Отличаются они от остальных тем, что организм может использовать их вместо, соответственно, метионина и фенилаланина для производства белка. Остальные 13 аминокислот синтезируются в организме человека в реакциях трансаминирования. Эти аминокислоты – «заменимые» – аланин, аргинин, аспарагин/аспарагиновая кислота, карнитин, цистеин, цистин, глутаминовая кислота, глутамин, глицин, гидроксипролин, пролин, серин, тирозин.
Аминокислоты всасываются из желудочно-кишечного тракта и с кровью поступают во все органы и ткани, где используются для синтеза белков и подвергаются различным превращениям. В крови поддерживается постоянная концентрация аминокислот. Из организма выделяется около 1 г азота аминокислот в сутки. В мышцах, ткани головного мозга и печени содержание свободных аминокислот во много раз выше, чем в крови, и менее постоянно. Концентрация аминокислот в крови позволяет судить о функциональном состоянии печени и почек. Содержание аминокислот в крови может заметно нарастать при нарушениях функции почек, лихорадочных состояниях, заболеваниях, связанных с повышенным содержанием белка.
Значение аминокислот не ограничивается их ролью в синтезе тканевых белков. Каждая из них выполняет в организме свои особые функции, направленные на поддержание гомеостаза организма.
Валин. Oдин из главных компонентов в росте и синтезе тканей тела. Основной источник – животные продукты. Опыты на лабораторных крысах показали, что валин повышает мышечную координацию и понижает чувствительность организма к боли, холоду и жаре.
Гистидин. Cпособствует росту и восстановлению тканей. В большом количестве содержится в гемоглобине; используется при лечении ревматоидных артритов, аллергий, язв и анемии. Недостаток гистидина может вызвать ослабление слуха.
Изолейцин. Поставляется всеми продуктами, содержащими полноценный белок – мясом, птицей, рыбой, яйцами, молочными продуктами.
Лейцин. Поставляется всеми продуктами, содержащими полноценный белок – мясом, птицей, рыбой, яйцами, молочными продуктами. Необходим не только для синтеза протеина организмом, но и для укрепления иммунной системы.
Лизин. Обеспечивает должное усвоение кальция; участвует в образовании коллагена (из которого затем формируются хрящи и соединительные ткани); активно участвует в выработке антител, гормонов и ферментов. Недавние исследования показали, что лизин, улучшая общий баланс питательных веществ, может быть полезен при борьбе с герпесом. Недостаток может выражаться в усталости, неспособности к концентрации, раздражительности, повреждению сосудов глаз, потере волос, анемии и проблем в репродуктивной сфере.
Метионин. Важен в метаболизме жиров и белков, организм использует ее также для производства цистеина. Является основным поставщиком сульфура, который предотвращает расстройства в формировании волос, кожи и ногтей; способствует понижению уровня холестерина, усиливая выработку лецитина печенью; понижает уровень жиров в печени, защищает почки; участвует в выводе тяжелых металлов из организма; регулирует образование аммиака и очищает от него мочу, что понижает нагрузку на мочевой пузырь; воздействует на луковицы волос и поддерживает рост волос.
Треонин. Важная составляющая в синтезе пуринов, которые, в свою очередь, разлагают мочевину, побочный продукт синтеза белка. Важная составляющая коллагена, эластина и протеина эмали; участвует в борьбе с отложением жира в печени; поддерживает более ровную работу пищеварительного и кишечного трактов; принимает общее участие в процессах метаболизма и усвоения.
Триптофан. Является первичным по отношению к ниацину (витамину В) и серотонину, который, участвуя в мозговых процессах, управляет аппетитом, сном, настроением и болевым порогом. Естественный релаксант, помогает бороться с бессонницей, вызывая нормальный сон; помогает бороться с состоянием беспокойства и депрессии; помогает при лечении головных болей при мигренях; укрепляет иммунную систему; уменьшает риск спазмов артерий и сердечной мышцы; вместе с лизином борется за понижение уровня холестерина.
Фенилаланин. Используется организмом для производства тирозина и трех важных гормонов – эпинэрфина, норэпинэрфина и тироксина. Используется головным мозгом для производства норэпинэрфина, вещества, которое передает сигналы от нервных клеток к головному мозгу; поддерживает нас в состоянии бодрствования и восприимчивости; уменьшает чувство голода; работает как антидепрессант и помогает улучшить работу памяти.
Тирозин. Используется организмом вместо фенилаланина при синтезе белка. Источники – молоко, мясо, рыба. Мозг использует тирозин при выработке норэпинэрфина, повышающего ментальный тонус. Многообещающие результаты показали попытки использовать тирозин как средство борьбы с усталостью и стрессами.
Цистин (цистеин). Если в рационе достаточное количество цистина, организм может использовать его вместо метионина для производства белка. Хорошие источники цистина – мясо, рыба, соя, овес и пшеница. Цистин используют в пищевой промышленности как антиоксидант для сохранения витамина С в готовых продуктах.
Аланин. Заменимая аминокислота. Является важным источником энергии для мышечных тканей, головного мозга и центральной нервной системы; укрепляет иммунную систему путем выработки антител; активно участвует в метаболизме сахаров и органических кислот.
Аргинин. Заменимая аминокислота. L-Аргинин вызывает замедление развития опухолей и раковых образований. Очищает печень. Помогает выделению гормона роста, укрепляет иммунную систему, способствует выработке спермы и полезна при лечении расстройств и травм почек. Необходим для синтеза протеина и оптимального роста. Наличие L-Аргинина в организме способствует приросту мышечной массы и снижению жировых запасов организма. Также полезен при расстройствах печени, таких, как цирроз печени, например. Не рекомендуется к приему беременными и кормящими женщинами.
Аспарагин. Заменимая аминокислота. Аспарагиновая кислота активно участвует в выводе аммиака, вредного для центральной нервной системы. Недавние исследования показали, что аспарагиновая кислота может повышать сопротивляемость усталости.
Глутамин. Заменимая аминокислота. Важен для нормализации уровня сахара, повышении работоспособности мозга, при лечении импотенции, при лечении алкоголизма, помогает бороться с усталостью, мозговыми расстройствами – эпилепсией, шизофренией и просто заторможенностью, нужен при лечении язвы желудка, и формирование здорового пищеварительного тракта.
Глутаминовая кислота считается естественным "топливом" для головного мозга, улучшает умственные способности, способствует ускорению лечения язв, повышает сопротивляемость усталости.
Глицин. Активно участвует в обеспечении кислородом процесса образования новых клеток. Является важным участником выработки гормонов, ответственных за усиление иммунной системы.
Пролин.Заменимая аминокислота. Предельно важен для правильного функционирования связок и суставов; также участвует в поддержании работоспособности и укреплении сердечной мышцы.
Серин. Заменимая аминокислота. Участвует в запасании печенью и мышцами гликогена; активно участвует в усилении иммунной системы, обеспечивая ее антителами; формирует жировые "чехлы" вокруг нервных волокон.
Лишение всех аминокислот приводит к совершенной потере белка организмом, истощению, полной потере энергии, потере веса, анемии, разрушению мышц, в самом тяжелом случае – к смерти.
§ 1 Классификация аминокислот
Простейший представитель – аминоуксусная кислота H2N-CH2-COOH (глицин)
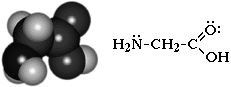
Аминокислоты классифицируют по нескольким признакам.
- В зависимости от взаимного расположения амино- и карбоксильной групп аминокислоты подразделяют на α-,β-,γ-,δ и т. д.
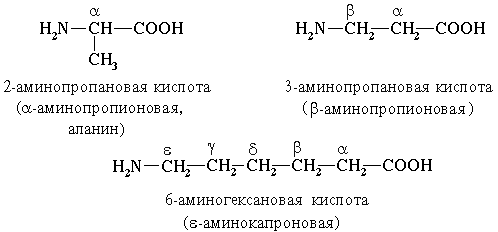
В природе встречаются и β-аминокислоты, RCH(NH2)CH2COOH, например β-аланин CH2NH2CH2COOH, входящий в состав пантотеновой кислоты.
- По характеру углеводородного радикала.В зависимости от строения радикала аминокислоты могут быть алифатическимии циклическими, из которых только одна (пролин) не является ароматической. Две аминокислоты – тирозин и фенилаланин – являются карбоциклическими и две (гистидин и триптофан) – гетероциклические. Приведенные выше аминокислоты относятся к жирному ряду. Примером ароматической аминокислоты может служить пара-аминобензойная кислота:
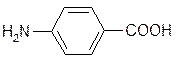 п-аминобензойная кислота
п-аминобензойная кислота
Гетероциклический фрагмент в строении имеют следующие аминокислоты: гистидин, пролин, гидроксипролин, триптофан.
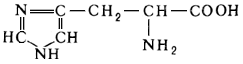
Гистидин
3.По количеству карбоксильных и аминогрупп в составе аминокислот различают дикарбоновые аминокислоты (кислого характера), т.к. они содержат две карбоксильные группы, и диаминомонокарбоновые аминокислоты (основного характера), в состав которых входит большее количество аминогрупп.
Моноаминомонокарбоновые кислоты:
Глицин – NH2CH2COOH
Аланин – CH3CH (NH2) COOH
Цистеин – CH2(SH)CH(NH2)COOH
Метионин – CH2 (SCH3) CH2CH (NH2) COOH
Валин – (СН3)2СНСН(NН2)СООН и др.
Моноаминодикарбоновые кислоты:
Аспарагиновая – HOOC CH2CH (NH2) COOH
Глутаминовая – HOOC (CH2)2CH (NH2) COOH
Диаминомонокарбоновые кислоты:
Лизин – NH2CH2(CH3)2CH(NH2)COOH
Аргинин – NH2C(=NH)NH(CH2)3CH(NH2)COOH и др.
Моноаминомонокарбоновые кислоты могут содержать и другие функциональные группы в своем составе. Например, гидроксиаминокислоты(серин, треонин, тирозин) и серосодержащиеаминокислоты (цистеин и метионин).
По характеру радикала аминокислоты подразделяют на неполярные(гидрофобныерадикалы) и полярные (гидрофильные радикалы).
К первой группе относятся аминокислоты как с алифатическим (аланин, валин, лейцин, изолейцин, метионин), так и с циклическим радикалом (фенилаланин, триптофан, пролин).
Ко второй группе принадлежат α-аминокислоты, в радикале которых имеются полярные функциональные группы как способные к ионизации (ионогенные), так и не способные (неионогенные). Поэтому вторую группу подразделяют на: полярные незаряженные (глицин, серин, треонин, цистеин, тирозин, аспарагин, глутамин), положительно заряженные (лизин, аргинин, гистидин) и отрицательно заряженные (аспарагиновая и глутаминовые кислоты). В растворах с рН>7.0 может происходить полная ионизация HS – групп цистеина и НО–групп тирозина, в результате чего они заряжаются отрицательно.
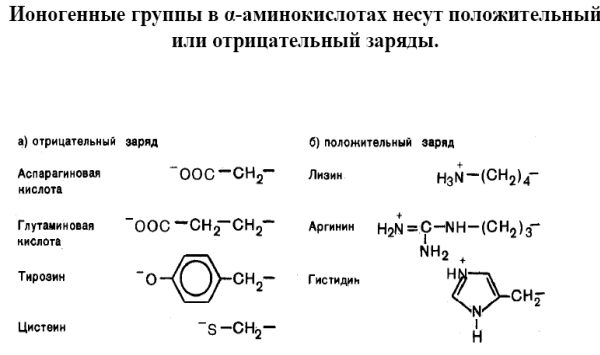
В белках ионогенные группы радикалов, расположенные на поверхности макромолекул, обуславливают электростатические взаимодействия и образование гидратной оболочки. Полярные неионогенные группы располагаются как на поверхности, так и внутри белковых молекул, участвуя в образовании водородных связей с другими полярными группами.
Номенклатура аминокислот
Наиболее широко для α-аминокислот применяются тривиальные названия, принятые международной номенклатурой ИЮПАК.
По систематической номенклатуре названия аминокислот образуются из названий соответствующих кислот прибавлением приставки амино и указанием места расположения аминогруппы по отношению к карбоксильной группе.
Например:
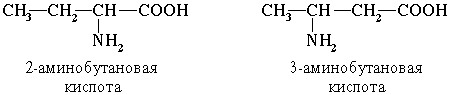
Часто используется также другой способ построения названий аминокислот, согласно которому к тривиальному названию карбоновой кислоты добавляется приставка амино –с указанием положения аминогруппы буквой греческого алфавита.
Пример:
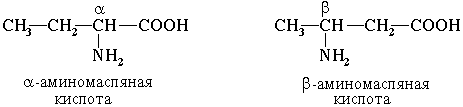
Для α-аминокислот, которые играют исключительно важную роль в процессах жизнедеятельности животных и растений, применяются тривиальные названия. Если в молекуле аминокислоты содержится две аминогруппы, то в ее названии используется приставка диамино-, три группы NH2 – триамино- и т.д.
Пример:
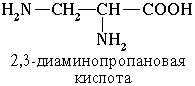
Наличие двух или трех карбоксильных групп отражается в названии суффиксом –диовая или -триовая кислота:
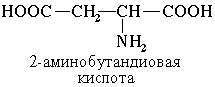
§ 3 Изомерия аминокислот
1. Изомерия углеродного скелета
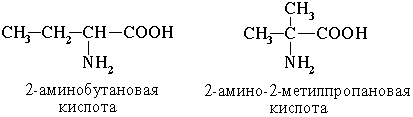
2.Изомерия положения функциональных групп
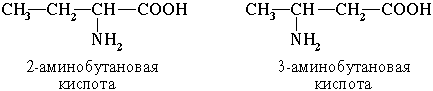
3. Оптическая изомерия
Все α-аминокислоты, кроме глицина H2N-CH2-COOH, содержат асимметрический атом углерода (α-атом) и могут существовать в виде оптических изомеров (зеркальных антиподов).

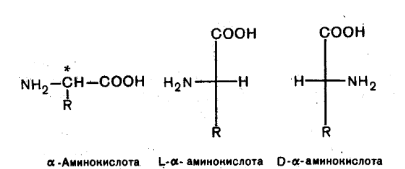


Все природные аминокислоты, кроме глицина, содержат асимметричные атомы углерода, существуют в оптически активных модификациях и, как правило, относятся к L-ряду. Большинство аминокислот L-ряда имеют сладкий вкус, а D-ряда – горький или безвкусны. Аминокислоты D-ряда содержатся только в некоторых антибиотиках и в оболочках бактерий (грамицидин С, актиномицин, полимиксин). Оптическая изомерия природных α -аминокислот играет важную роль в процессах биосинтеза белка.
Вкус α-аминокислот.Сладкие L – аминокислоты: глицин, серин, пролин, аланин.
Вопрос 3.Биполярнаяструктура аминокислот и образование хелатов.
Аминокислоты — бесцветные кристаллические вещества, растворимые в воде; tпл 220—315°С, при плавлении разлагаются. Хорошо растворимы в воде, водные растворы электропроводны. Растворимость аминокислот в воде варьируется в широких пределах в зависимости от природы радикала и, главным образом, от наличия в молекуле гидрофильных или гидрофобных групп. Растворимость аминокислот в спирте значительно ниже, а в эфире, хлороформе и других органических растворителях они практически не растворяются. Высокая температура плавления аминокислот связана с тем, что их молекулы имеют структуру главным образом амфотерных (двузарядных) ионов. Например, строение простейшей аминокислоты — глицина — можно выразить формулой:
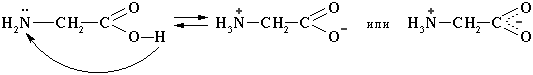
В водных растворах α-аминокислоты существуют в виде равновесной смеси диполярного иона, катионной и анионной форм:
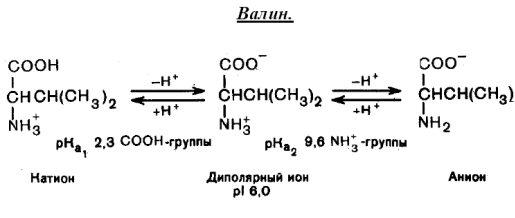
Положение равновесия зависит от рН среды. Общим для всех α-аминокислот является преобладание катионных форм в сильнокислых (рН 1-2) и анионных – в сильнощелочных (рН 13-14) средах.
Значение рН, при котором суммарный заряд молекулы аминокислоты или белка равен нулю, а концентрация биполярного иона максимальна, называется изоэлектрической точкой (ИЭТ),а такое состояние молекулы – изоэлектрическим состоянием.
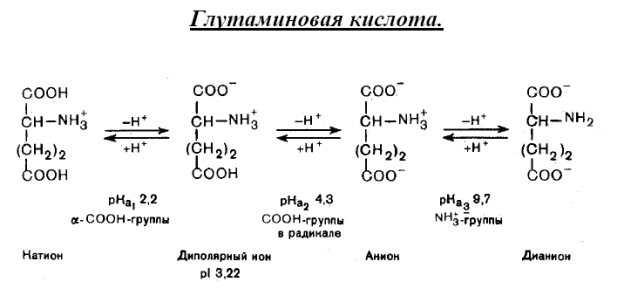 Для аминокислот кислотногохарактера ИЭТ находится в сильнокислой среде (у аспарагиновой кислоты рН=2.8, глутаминовой -3.2), нейтрального характера – в слабокислой среде, основного характера – в сильнощелочной ( у лизина – рН 9.6, у аргинина – 10.8 ).
Для аминокислот кислотногохарактера ИЭТ находится в сильнокислой среде (у аспарагиновой кислоты рН=2.8, глутаминовой -3.2), нейтрального характера – в слабокислой среде, основного характера – в сильнощелочной ( у лизина – рН 9.6, у аргинина – 10.8 ).
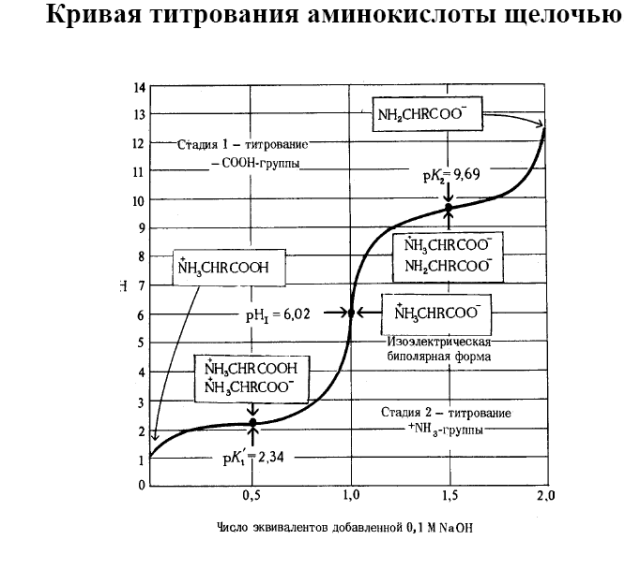
В ИЭТ молекула не перемещается в постоянном электрическом поле ни к катоду, ни к аноду. При рН ниже ИЭТ α- аминокислота заряжается положительно и движется к катоду, при рН выше ИЭТ приобретает отрицательный заряд и движется к аноду. На этом основано разделение аминокислот и белков методами электрофореза и ионообменной хроматографии, которые позволяют идентифицировать и количественно определить их содержание в растворах и биологических жидкостях.
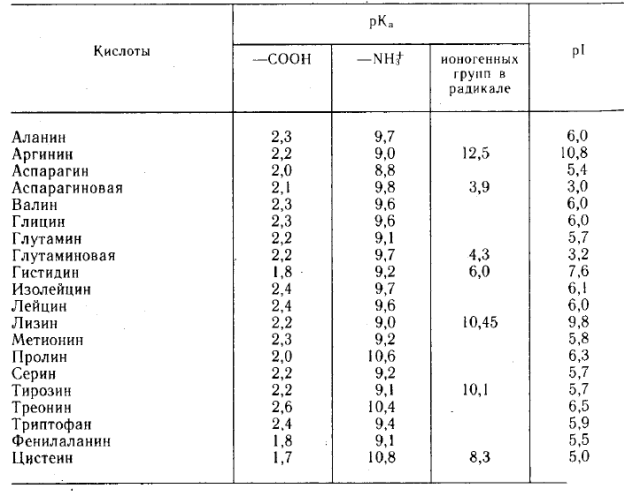
Таблица 2
Кислотно-основные свойства аминокислот
Вопрос 4. Химические свойства аминокислот: кислотно-оснόвные свойства, декарбоксилирование, переаминирование, реакции по карбоксильной группе и аминогруппе, хелатообразование.
Реакции, протекающие по карбоксильной группе.
Как карбоновые кислоты они образуют функциональные производные:
а) соли
H2N–CH2–COOH + NaOH H2N–CH2–COO Na+ + H2O
б) сложные эфиры
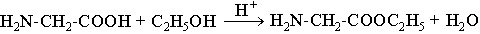
Для карбоксильной группы характерны реакции ацилирования: при взаимодействии со спиртами в присутствии сильных кислот образуются сложные эфиры: 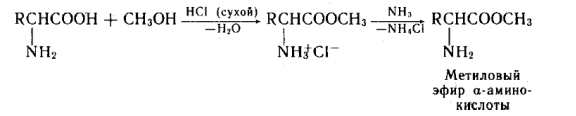
Таким образом, в кислой среде, когда аминогруппа блокирована протоном, аминокислоты выступают ацилирующим реагентом, т.е. донором ацильной группы, а в щелочной среде за счет свободной аминогруппы они выступают акцептором ацильной группы от сильного ацилирующего реагента, напрмер, хлорангидрида карбоновой кислоты, при этом образуются N- ацильные производные аминокислот.
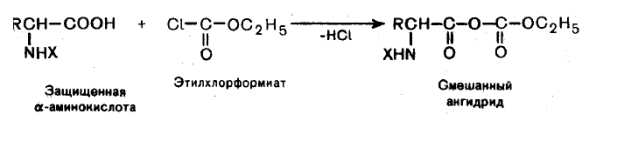
Образование галогенангидридов. При действии на аминокислоты с защищенной аминогруппой оксид-дихлоридом серы (хлористым тионилом) или оксид-трихлоридом фосфора образуются хлорангидриды защищенных аминокислот: 
Хлорангидриды аминокислот более реакционноспособны в реакциях нуклеофильного замещения, чем аминокислоты, например, в реакциях саммиаком :
R – CH(NH2) – COCl + NH3→ R – CH(NH2) – CONH2 + HCl
Эта реакция имеет важное значение для обезвреживания аммиака в клетке, образующегося в процессах дезаминирования аминокислот, аминов и амидов.
Декарбоксилирование – важный путь распада аминокислот в организме. В α-аминокислотах электроноакцепторная группа – NH3+ расположена в α-положении к группе – СОО-. Это вызывает сильную поляризацию связи между атомами углерода и способствует ее разрыву с образованием СО2, т.е. декарбоксилированию. В организме реакция катализируется декарбоксилазами, активность которых определяется пиридоксальфосфатом. В результате декарбоксилирования из α-аминокислот образуются биогенные амины:
R – CH(NH2) - COOH → RCH2 - NH2 + CO2
Аналогично происходит образование гистамина из гистидина, а из триптофана – триптамина и серотонина.
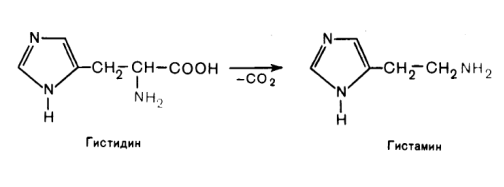
Гистаминобладает широким спектром физиологического действия: расширяет капилляры, ускоряет приток лейкоцитов в очаг воспаления, способствует активизации защитных сил организма, усиливает секрецию соляной кислоты в желудке, имеет прямое отношение к явлениям сенсибилизации и десенсибилизации, влияет на рецепторы сосудов, являясь нейромедиатором, участвует в болевом синдроме.
Реакции, протекающие по аминогруппе.Подобно аминам, аминокислоты реагируют с кислотами с образованием солей аммония:
H2N–CH2–COOH + HCl → [H3N–CH2–COOH]+Сl-
Реакция ацилирования протекает в слабощелочной среде, используется для защиты аминогруппы:
НООС – CH(R) –NH2 + R1 – COCl → HOOC – CH(R) – NH – CO –R1 + HCl
Реакция алкилирования (для защитыα-аминогруппы)
H2N – CH2–COOH + R1–Hal→ R1 –NH – CH2 – COOH +H-Hal
Реакция с азотистой кислотой. Подобно первичным аминам, аминокислоты реагируют с азотистой кислотой, при этом аминогруппа превращается в гидроксогруппу, а аминокислота — в гидроксикислоту:
H2N-CH(R)-COOH + HNO2 → HO-CH(R)-COOH + N2↑+ H2O
Измерение объема выделившегося азота позволяет определить количество аминокислоты (метод Ван-Слайка).
Аминокислоты могут реагировать со спиртами в присутствии газообразного хлороводорода, превращаясь в сложный эфир (точнее, в хлороводородную соль эфира):
H2N-CH(R)-COOH + R'OH 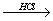 H2N-CH(R)-COOR' + Н2О.
H2N-CH(R)-COOR' + Н2О.
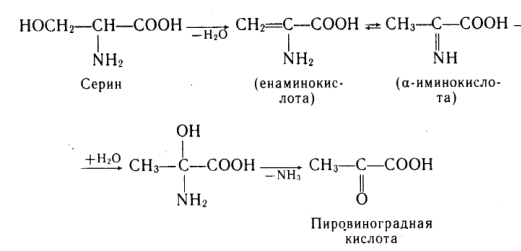
Элиминирование –путь трансформации аминокислот с функциональной группой в β-положении.

В организме протекает реакция элиминирования серина:
C альдегидами.С формальдегидом в слабощелочной среде аминокислоты легко переходят в моноанион, содержащий свободную аминогруппу, поэтому легко вступают в реакцию нуклеофильного присоединения к формальдегиду. При взаимодействии α-аминокислот с альдегидами образуются замещенные имины (основания Шиффа) через стадию образования карбиноламинов.
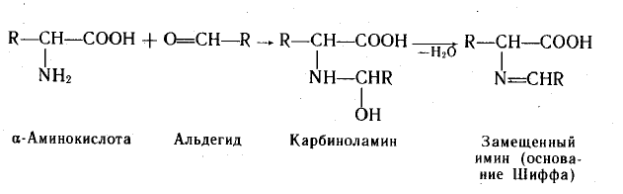
Амфотерный характер α –аминокислот не позволяет непосредственно проводить титрование их щелочью в аналитических целях. При взаимодействии аминокислот с формальдегидом получаются относительно устойчивые карбиноламины – N-метилольные производные, в которых наличие свободной карбоксильной группы позволяет провести титрование щелочью.
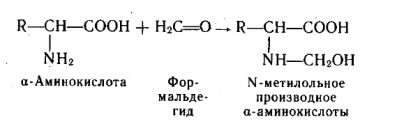
В таких производных аминокислот основность атома азота сильно понижена, что позволяет использовать эту реакцию для количественного определения α-аминокислот методом Серенсена. Способность аминогрупп в аминокислотах и белках взаимодействовать с формальдегидом приводит к необратимой денатурации белков. Этим объясняется высокая токсичность формальдегида и его стерилизующая способность.
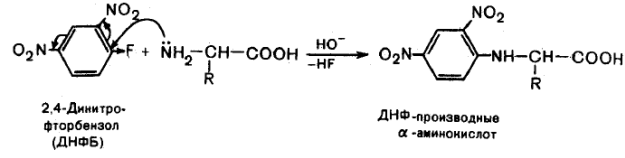
Образование ДНФ – производных. Αминокислоты образуют с 2,4-динитрофторбензолом окрашенные в желтый цвет динитрофенильные производные (ДРФ-производные), растворимые в органических растворителях. Они экстрагируются из реакционной смеси органическими растворителями и используются для идентификации хроматографическими методами.
Данная реакция протекает по механизму нуклеофильного замещения в бензольном кольце. Такое замещение становится возможным за счет влияния двух сильных электроноакцепторных нитрогрупп:
Образование ФТГ-производных (реакция Эдмана). Эта реакция широко используется при установлении строения пептидов. Взаимодействие аминокислот с фенилизотиоционатом протекает по механизму нуклеофильного присоединения. В образовавшемся продукте далее осуществляется внутримолекулярная реакция нуклеофильного замещения, приводящая к образованию циклического замещенного амида.
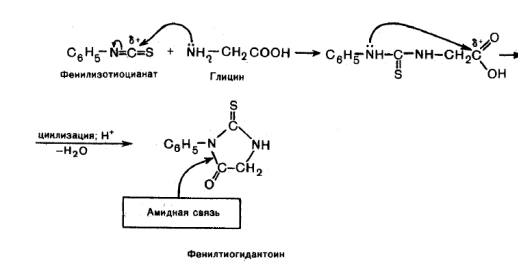
Циклические соединения, получаемые по данной реакции, представляют собой производные тиогидантоина, поэтому для них принято название фенилтиогидантоиновых производных (ФТГ – производных) α-аминокислот. Такие производные отличаются строением радикала R.
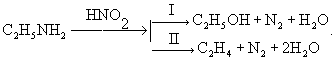
Дезаминирование, отщепление (элиминирование) аминогруппы (NH2) из органических соединений. Дезаминирование сопровождается замещением аминогруппы какой-либо др. группой (например, Н, ОН, OR, Hal) или образованием двойной связи. Дезаиминирование производят, в частности, действием на первичные амины азотистой кислотой. При этом из алифатических аминов образуются спирты (I) и олефины (II), например:
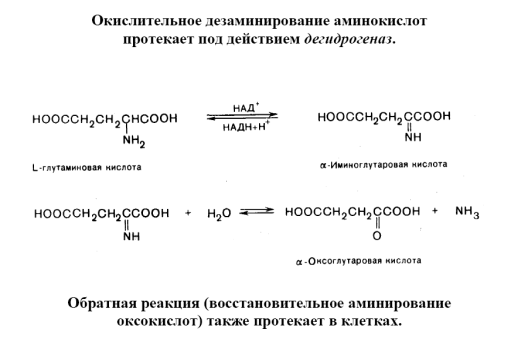
Дезаминирование циклоалифатических аминов сопровождается расширением или сужением цикла. Ароматические амины дают с азотистой кислотой (в присутствии сильных неорганических кислот) диазония соли. Такие реакции, как гидролиз, гидрогенолиз, расщепление четвертичных аммониевых солей, пиролитические и др., также приводят к реакции дезаминитрования. Важную роль играет эта реакция в процессах жизнедеятельности животных, растений и микроорганизмов. Для α-aминокислот характерно окислительное дезаминирование. с образованием аммиака и -кетокислот. Окислительному дезаминированию подвергаются также амины. Оксидазы природных аминокислот, кроме глутаматдегидрогеназы, дезаминирующей L-глутаминовую кислоту, в животных тканях мало активны. Поэтому большинство L-аминокислот подвергается непрямому дезаминированию путём предварительного переаминирования с образованием глутаминовой кислоты, которая затем претерпевает окислительное Ддезаминирование или др. превращения. Др. типы дезаминирования — восстановительное, гидролитическое (дезаминирование. аминопроизводных пуринов, пиримидинов и сахаров) и внутримолекулярное (дезаминирование. гистидина) — в большей степени распространены у микроорганизмов.
Внутримоекулярное дезаминирование
R–CH2 – CH(NH2)– COOH→ R–CH=CH–COOH + NH3
α,β – ненасыщенная кислота
Гидролитическое дезаминирование
R–CH(NH2) – COOH +H2O → R – CH(OH) – COOH + NH3
α - оксикислота
Окислительное дезаминирование
R-CH(NH2) – COOH +1/2 O2→ R –C(O) – COOH + NH3
α-кетокислота
Переаминирование, трансаминирование, обратимый перенос аминогруппы (—NH2) от аминокислот или аминов к оксокислотам:
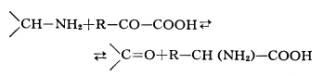
Реакция ферментативного переаминирования, открытая в 1937 советскими биохимиками А. Е. Браунштейном и М. Г. Крицман, играет роль важного промежуточного звена в процессах синтеза и дезаминирования многих аминокислот у животных, растений и микроорганизмов. Большинство природных аминокислот синтезируется в тканях путём переноса NH2-группы от глутаминовой кислоты — начального продукта усвоения азота — на различные оксокислоты. Обеспечивая быстрое взаимопревращение различных амино- и оксокислот, реакции переаминирования играют важную роль в регуляции и сопряжении обмена аминокислот и углеводов, ферменты переаминирования— аминотрансферазы имеются во всех живых клетках. Описано свыше 55 различных аминотрансфераз, катализирующих эту реакцию всех известных природных аминокислот и ряда биогенных аминов. Коферментом аминотрансфераз является производное витамина B6 — пиридоксальфосфат, играющий роль переносчика NH2-группы .Резкое повышение содержания некоторых аминотрансфераз в плазме крови больных служит диагностическим признаком при поражениях печени (гепатиты), сердца (инфаркт миокарда), мышц (травмы, миодистрофические заболевания).
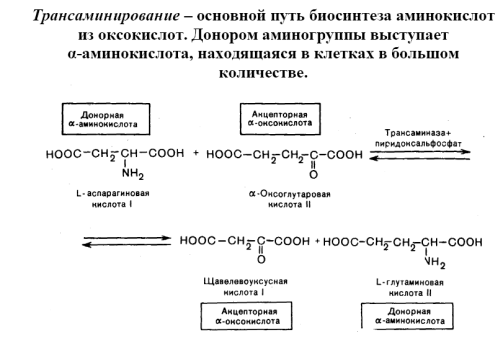
Кроме того, возможно взаимодействие амино- и карбоксильной групп как внутри одной молекулы (внутримолекулярная реакция), так и принадлежащих разным молекулам (межмолекулярная реакция).
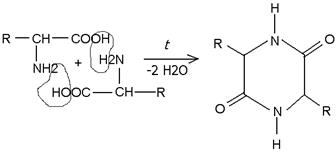
При нагревании в сухом виде различные аминокислоты ведут себя по разному. Так, -аминокислоты образуют циклические дипептиды, называемые дикетопиперазинами:
-аминокислоты претерпевают дезаминирование:
СН3-СН2-СН(NH2)-CH2-COOH → СН3-СН=СН-CH2-COOH + NH3
- аминокислоты превращаются в циклические внутримолекулярные пептиды- лактамы:
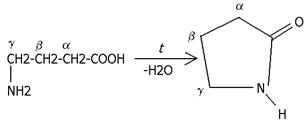
Практическое значение имеет внутримолекулярное взаимодействие функциональных групп -аминокапроновой кислоты, в результате которого образуется -капролактам (полупродукт для получения капрона):
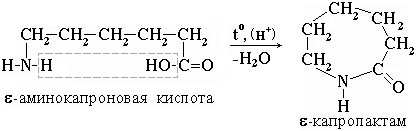
Образование комплексов с металлами.α-Аминокислоты образуют с катионами тяжелых металлов внутрикомплексные соли. Со свежеприготовленным гидроксидом меди(II) все α-аминокислоты в мягких условиях дают хорошо кристаллизующиеся внутрикомплексные (хелатные) соли меди(II) синего цвета:
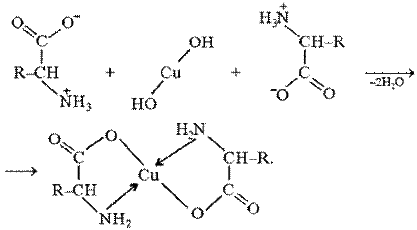
В таких солях ион меди координационными связями соединен с аминогруппами.
Реакционная способность радикала обусловлена наличием НО-, SH- групп или ароматичсеского ядра. Важнейшими из них являются окислительно-восстановительные реакции, β-декарбоксиилрование, диметилирование, переметилирование, которые ведут к переходу одних аминокислот в другие, что расширяет возможности синтеза различных аминокислот (например, окисление фенилаланина в тирозин).
При полном окислении тиоловой группы цистеин превращается в цистеиновую кислоту, которая декарбоксилируясь, превращается в таурин, образующий с желчными кислотами парные желчные кислоты (таурохолевую и тауродезоксихолевую).
HS – CH2-CH(NH2) – COOH + ½ O2→ HO3S – CH2 – CH(NH2) - COOH→
цистеин цистеиновая кислота
→CO2 + H2N – CH2 – CH2 –SO3H
таурин
Вопрос 5.Строение пептидной связи. Лактам-лактимная таутомерия.
Межмолекулярное взаимодействие -аминокислот приводит к образованию пептидов. При взаимодействии двух -аминокислот образуется дипептид.
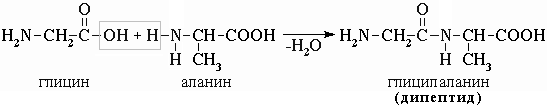
Межмолекулярное взаимодействие трех -аминокислот приводит к образованию трипептида и т.д.
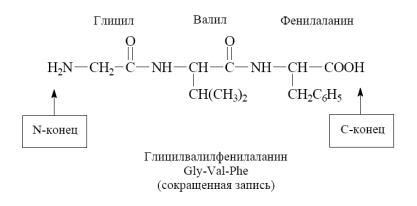
Фрагменты молекул аминокислот, образующие пептидную цепь, называются аминокислотными остатками, а связь CO–NH - пептидной связью.
Дата добавления: 2016-11-04; просмотров: 13650;










