Различают химические процессы проходящие
1) при постоянном объеме – изохорные,
2) при постоянном давлении – изобарные,
3) при постоянной температуре – изотермические.
Чаще всего в химии приходится иметь дело с процессами, протекающими при постоянном давлении. При этом удобно пользоваться функцией состояния, которая называется энтальпия (Н). Энтальпия - это термодинамическая функция состояния, которая характеризует энергетическое состояние  вещества, но включает в себя и внутренняя энергию и энергию, затрачиваемую на работу. Изменение энтальпии определяемой соотношением:
вещества, но включает в себя и внутренняя энергию и энергию, затрачиваемую на работу. Изменение энтальпии определяемой соотношением: 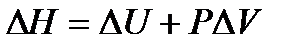 .
.
Если в процессе объем системы ( 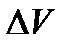 = 0) не изменяется, значит и работа расширения равна 0. Поэтому для процессов, при которых давление и объем практически не меняются, изменение энтальпии равно изменению внутренней энергии.
= 0) не изменяется, значит и работа расширения равна 0. Поэтому для процессов, при которых давление и объем практически не меняются, изменение энтальпии равно изменению внутренней энергии. 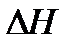 = ΔU = - ΔQ.
= ΔU = - ΔQ.
В литературе можно встретить и другие варианты приведённого выше соотношения, отличающиеся от него знаками ( 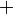 или
или  ). Все зависит от того, рассматриваем мы систему с точки зрения теплотехники или термохимии. В «термохимическом правиле знаков для теплоты» положительной считают теплоту, отдаваемую системой, а отрицательной — теплоту, получаемую системой. Т.е. в химии все рассматривается с точки зрения системы. Если в системе уменьшается внутренняя энергия, значит, она выделилась в виде тепла или работы. Если реакция протекает с выделением энергии (чаще всего в виде тепла), считают что ΔQ > 0 ,( и это значит, что
). Все зависит от того, рассматриваем мы систему с точки зрения теплотехники или термохимии. В «термохимическом правиле знаков для теплоты» положительной считают теплоту, отдаваемую системой, а отрицательной — теплоту, получаемую системой. Т.е. в химии все рассматривается с точки зрения системы. Если в системе уменьшается внутренняя энергия, значит, она выделилась в виде тепла или работы. Если реакция протекает с выделением энергии (чаще всего в виде тепла), считают что ΔQ > 0 ,( и это значит, что 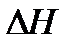 <0 и
<0 и 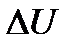 <0), реакцию называют экзотермической. Если система получила дополнительную энергию в виде тепла или над системой совершена работа – значит, внутренняя энергия системы стала больше. Если реакция протекает с поглощением энергии,считают чтоΔQ < 0 , (и это значит
<0), реакцию называют экзотермической. Если система получила дополнительную энергию в виде тепла или над системой совершена работа – значит, внутренняя энергия системы стала больше. Если реакция протекает с поглощением энергии,считают чтоΔQ < 0 , (и это значит 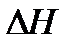 > 0 ,
> 0 , 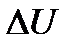 > 0), реакцию называют эндотермической.
> 0), реакцию называют эндотермической.
Тепловые эффекты химических реакций можно указывать в химических уравнениях, и тогда они называются термохимические уравнения.Например, в термохимических уравнениях мы можем записать:
2Н2 + О2 = 2Н2О (г) + 136,8 ккал/моль или
2Н2 + О2 = 2Н2О (г) ∆Н = -136,8 ккал/моль ,
Это будет означать, что в этой реакции энергия выделяется т.к. ΔQ > 0, а энтальпия (и внутренняя энергия тоже!) уменьшается т.к. 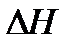 <0. Т.е. реакция образования воды, о которой идет речь выше – экзотермическая.
<0. Т.е. реакция образования воды, о которой идет речь выше – экзотермическая.
Еще одна формулировка первого начала термодинамики - это закон Лавуазье – Лапласа, который читается так: Если при образовании какого-либо соединения выделяется некоторое количество теплоты, то при разложении этого соединения в тех же условиях такое же количество теплоты будет поглощаться.
Значит термохимическое уравнение реакции разложения воды мы запишем:
2Н2О (г) = 2Н2 (г) + О2(г) - 136,8 ккал/моль или ∆Н = 136,8 ккал/моль
Дата добавления: 2021-02-19; просмотров: 515;











