Иначе говоря, если прямая реакция – экзотермическая, то обратная будет эндотермическая.
Очень часто надо знать, какой тепловой эффект будет при образовании одного моля вещества. Мы знаем, что если все величины в уравнении разделить или умножить на определенное число, то равенство сохранится. Разделим в уравнении все величины на 2.
Н2(г) + 0,5О2(г) = Н2О (г) ∆Н0 = - 68,3 ккал/моль (или 242 кДж/моль)
Количество теплоты, выделяющейся (или поглощающейся) при образовании одного моля соединения из простых веществ, называется теплотой образования.(Обратите внимание: в термохимических уравнениях часто используют дробные коэффициенты).
Если образовании 1 моль (18 г) воды из простых веществ водорода и кислорода выделится 68,3 ккал теплоты, значит теплота образования воды равна 68,3 ккал/моль. Естественно, величина теплового эффекта зависит не только от природы веществ, но и от их агрегатного состояния, а также от температуры, при которой протекает реакция. Поэтому в термохимических уравнениях указывают не только формулы веществ, но и их агрегатное состояние, и измерения проводят всегда при постоянной температуре 250С и 1 атм давления (эти условия называют стандартными и об этом говорит «0» около значения ∆Н0). Эта величина (∆Н0 = - 68,3 ккал/моль) является константой (постоянной величиной) для воды. Такие теплоты образования называют стандартными. Они указаны в специальных таблицах и используются в термохимических расчетах. Энтальпия образования простых веществ принимается равной нулю
На практике часто используют понятие «теплота сгорания». Теплота сгорания - количество теплоты, выделяющейся при окислении одного моля какого-то соединения.Например:
С2Н2(г) + 2,5О2(г) = Н2О(г) + СО2(г) + 310,1 ккал/моль или
С2Н2(г) + 2,5О2(г) = Н2О(г) + СО2(г) ∆Н0 = -310,1 ккал/моль
Здесь 310,1 ккал/моль - это теплота сгорания ацетилена.
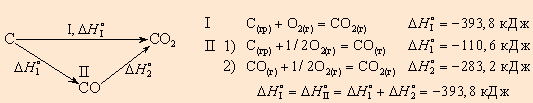 Пользуясь табличными значениями теплоты образования и теплоты сгорания, можно рассчитать энтальпии различных химических процессов и фазовых превращений. Основанием для таких расчетов является закон Гесса(1841) – это еще одна формулировка закона сохраненияэнергии:Тепловой эффект (энтальпия) процесса зависит только от начального и конечного состояния системы и не зависит от пути перехода системы из одного состояния в другое. Закон Гесса позволяет обращаться с термохимическими уравнениями как с алгебраическими, т. е. складывать и вычитать их, если термодинамические функции относятся к одинаковым условиям. Например, диоксид углерода можно получить прямым синтезом из простых веществ (I) или в две стадии через промежуточный продукт (II):
Пользуясь табличными значениями теплоты образования и теплоты сгорания, можно рассчитать энтальпии различных химических процессов и фазовых превращений. Основанием для таких расчетов является закон Гесса(1841) – это еще одна формулировка закона сохраненияэнергии:Тепловой эффект (энтальпия) процесса зависит только от начального и конечного состояния системы и не зависит от пути перехода системы из одного состояния в другое. Закон Гесса позволяет обращаться с термохимическими уравнениями как с алгебраическими, т. е. складывать и вычитать их, если термодинамические функции относятся к одинаковым условиям. Например, диоксид углерода можно получить прямым синтезом из простых веществ (I) или в две стадии через промежуточный продукт (II):
Математически это можно записать так:
ΔНхимической реакции= ΣΔНпродуктов реакции - Σν∙ΔНисходных веществ
Энтальпия химической реакции равна разности сумм энтальпий образования продуктов реакции и исходных веществ с учетом их стехиометрических коэффициентов.
 В ходе химической реакции энергия затрачивается на разрушение связей в исходных веществах и выделяется при образовании связей в продуктах реакции. Следовательно, экзотермический эффект реакции свидетельствует о том, что образуются соединения с более прочными связями, чем исходные. В случае эндотермической реакции, наоборот, прочнее исходные вещества.
В ходе химической реакции энергия затрачивается на разрушение связей в исходных веществах и выделяется при образовании связей в продуктах реакции. Следовательно, экзотермический эффект реакции свидетельствует о том, что образуются соединения с более прочными связями, чем исходные. В случае эндотермической реакции, наоборот, прочнее исходные вещества.
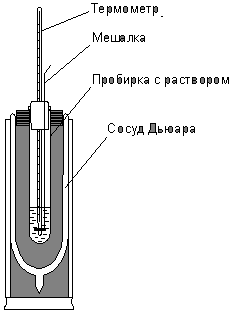
Для определения тепловых эффектов, сопровождающих химические реакции, применяются специальные приборы, называемые калориметрами. Схематично такой прибор изображен на рисунке. Калориметрическое определение ведется так, чтобы вся химическая энергия выделялась в виде теплоты или могла быть учтена в виде работы расширения газа. Такой способ называют прямой калориметрией.
По закону Гесса можно рассчитывать для химической реакции и другие функции состояния. Практически важным выводом из закона Гесса и закона Лавуазье – Лапласа является возможность вычислять тепловые эффекты в тех случаях, когда их нельзя измерить непосредственно. Это называется непрямой калориметрией.
Основы биоэнергетики и применение калориметрии в медицине.
Всем живым организмам для роста и функционирования нужна энергия. Растения могут использовать энергию солнца (фотосинтез), а животные и человек получают энергию только за счет окисления пищевых продуктов.
Чтобы доказать применимость первого закона термодинамики для живых организмов, еще в 18 веке Лавуазье и Лаплас изучали теплообмен морской свинки в калориметре. Для человека это сделать, конечно, сложнее. Поэтому в настоящее время энергетический баланс человека изучается не только методами измерения тепловых эффектов, но и с помощью термохимических расчетов. C Данные прямой калориметрии используют в расчетах непрямой калориметрии, где на основании установленных дыхательных коэффициентов и калориметрического эквивалента определяются энергетические затраты организма.
Исследования показывают: организм человека не продуцирует новую энергию, все работы в организме совершаются за счет энергии выделяющейся при окислении питательных веществ. Основная часть этой энергии задерживается в организме в виде химической энергии, а не выделяется в виде теплоты.
В процессе эволюции живых организмов выработалась определенная последовательность и скорость биологического окисления. За счет энергии, которая выделяется при окислении глюкозы, карбоновых кислот и других продуктов распада питательных веществ (углеводов, жиров, белков), образуются АТФ, АДФ, креатинфосфат, ацетилфосфат и другие соединения, которые накапливаются в клетке. Т.е. можно сказать, что энергия, которая выделяется в реакциях окисления, накапливается в связях некоторых Р-содержащих веществ. Эти вещества называют макроэргами. По мере необходимости макроэрги, легко распадаются (подвергаются гидролизу), и при этом энергия, которая потратилась на их образование, выделяется. Эта энергия расходуется на синтез белка и других веществ, мышечную работу, работу нервной системы, работу внутренних органов и высшую нервную деятельность. Главным из макроэргов является аденозинтрифосфат (АТФ) - энергетическая валюта организма.
Закон сохранения энергии утверждает, что организм человека должен тратить энергии столько, сколько ее получает. Что произойдет, если тратить больше, чем получаешь? А если меньше? Что означает, если человек, питается нормально и образ жизни обычный, но резко худеет?
Сравнение энергетики здоровых и больных клеток позволяет изучать различные патологические явления, разрабатывать диагностику и методы лечения некоторых заболеваний, например, ожирения. На основании данных о калорийности продуктов составляются нормы потребностей в пищевых веществах для разных групп населения, с учетом возраста, пола, характера труда, заболевания, климата и т.д.
3. 2-й закон термодинамики называют законом возрастания энтропии, он определяет возможность протекания процесса в системе и его направление. У него тоже имеется несколько различных, но в то же время эквивалентных формулировок. Встречающиеся в литературе различные формулировки второго начала термодинамики являются частными следствиями закона возрастания энтропии. История открытия второго начала термодинамики представляет собой одну из самых замечательных, полную драматизма глав общей истории науки, последние страницы которой ещё далеко не дописаны. Потребовались усилия не одного, а многих национальных гениев, для того чтобы приоткрыть завесу над сокровенной тайной природы, которую мы называем сейчас вторым началом термодинамики.
1 — Постулат Клаузиуса (1850 г). Чаще всего постулат Клаузиуса формулируют так: Теплота не может переходить самопроизвольно от более холодного тела к более тёплому.
2 — Постулат Томсона (барона Кельвина). Чаще всего постулат Кельвина формулируют так: Невозможно превратить в работу всю внутреннюю энергию системы, не проводя других изменений в системе.
Это означает, что в реальных системах только часть энергии превращается в полезную работу, другая часть является «связанной». Для характеристики этой «связанной» энергии Клаузиус ввел новую функцию состояния– энтропию (S).
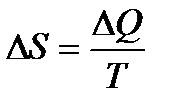 ≥ 0.Эта формула - аналитическое выражение второго закона термодинамики. Энтропия является признаком обмена энергией в форме теплоты. Изменение величины энтропии характеризует наличие теплообмена между системой и окружающей средой. Если система поглощает теплоту, ее энтропия возрастает, если система теплоту теряет, энтропия уменьшается. Абсолютное значение энтропии системы, как и любого другого термодинамического потенциала, измерить нельзя. Можно говорить только об изменении этой величины, т.е. ΔS.
≥ 0.Эта формула - аналитическое выражение второго закона термодинамики. Энтропия является признаком обмена энергией в форме теплоты. Изменение величины энтропии характеризует наличие теплообмена между системой и окружающей средой. Если система поглощает теплоту, ее энтропия возрастает, если система теплоту теряет, энтропия уменьшается. Абсолютное значение энтропии системы, как и любого другого термодинамического потенциала, измерить нельзя. Можно говорить только об изменении этой величины, т.е. ΔS.
Можно сказать, что энтропия является мерой упорядоченности вещества. Чем больше неупорядоченность, тем больше энтропия.Где больше «порядка»: в кристаллическом веществе или жидкости? В воде при 200С или при 800С?
В изолированной системе при самопроизвольных процессах энтропия (степень неупорядоченности) остаётся либо неизменной, либо возрастает (в неравновесных процессах), достигая максимума при установлении термодинамического равновесия.
Абсолютное значение энтропии можно вычислить теоретически, пользуясь постулатом Планка: энтропия кристаллического вещества при абсолютном нуле равна нулю. Этот постулат иногда называют третьим законом термодинамики. Этот постулат означает, что и энтропия, и температура ограничены снизу, т.е. не могут быть меньше некоторых предельных значений. Отсюда появляется понятие абсолютного нуля. Т.е. Температура ноль градусов по абсолютной шкале (шкале Кельвина) - это теоретически рассчитанная температура, при которой прекратится всякое тепловое движение…
Следствием из второго начала термодинамики является возможность предсказать,будет ли проходить и в каком направлении химическая реакция или биологический процесс. Самопроизвольно обычно протекают процессы, идущие с увеличением энтропии ( 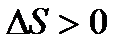 ), т.е. с выделением тепла или увеличением числа частиц и скорости их движения… - так тоже можно сформулировать 2 закон термодинамики.
), т.е. с выделением тепла или увеличением числа частиц и скорости их движения… - так тоже можно сформулировать 2 закон термодинамики.
Но если ориентироваться только на энтропию – можно ошибиться. Ведь растения и животные – это сложные структуры, они самопроизвольно развиваются, казалось бы, в противоречие второму закону термодинамики, т.е. из множества маленьких и простых частиц образуется одна большая и сложная, а не наоборот. Поэтому были предложены другие термодинамические функции, которые могут служить критерием возможности самопроизвольного протекания процесса. Чаще всего пользуются изобарно-изотермическим потенциалом, т.н.свободной энергией Гиббса (G). Оставив в стороне математические выкладки, просто запомним, что изменение свободной энергии Гиббса зависит не только от энтропии (а значит и внутренней энергии) и от энтальпии: 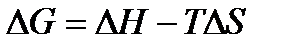 .
.
если 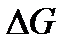 = 0, система находиться в равновесии, G имеет минимальное значение для данной системы при данных условиях
= 0, система находиться в равновесии, G имеет минимальное значение для данной системы при данных условиях
если 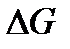 > 0, самопроизвольные процессы невозможны, они могут протекать только под действием окружающей среды («энергетический пинок»)
> 0, самопроизвольные процессы невозможны, они могут протекать только под действием окружающей среды («энергетический пинок»)
если 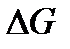 <0, процесс может протекать самопроизвольно, при этом внутренняя энергия системы должна уменьшаться.
<0, процесс может протекать самопроизвольно, при этом внутренняя энергия системы должна уменьшаться.
Поэтому второй закон можно сформулировать так: Самопроизвольно протекают только процессы, для которых 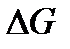 <0, т.е. идущие с уменьшением энергии Гиббса в направлении равновесия системы.
<0, т.е. идущие с уменьшением энергии Гиббса в направлении равновесия системы.
4. Величину изменения энергии Гиббса можно использовать для определения возможности или невозможности протекания тех или иных процессов и в живых организмах.
В организме часто энергетически невыгодная, но необходимая для метаболизма реакция реализуется за счет другой, в ходе которой эта энергия освобождается. Т.е. две реакции проходят параллельно, их сопряжение происходит благодаря специальному ферменту, объединяющему оба процесса в один.
Например, первая стадия гликолиза:
глюкоза + НРО42- =глюкозо-6-фосфат + Н2О, имеет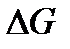 =13,4кДж/моль т.е. больше нуля, это значит, что реакция самопроизвольно протекать не может. Но она спряжена с другой реакцией - гидролизом АТФ, идущей с выделением тепла. Суммарную реакцию можно записать так:
=13,4кДж/моль т.е. больше нуля, это значит, что реакция самопроизвольно протекать не может. Но она спряжена с другой реакцией - гидролизом АТФ, идущей с выделением тепла. Суммарную реакцию можно записать так:
глюкоза + АТФ = глюкозо-6-фосфат + АДФ, для которой 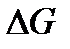 = -17,2 кДж/моль. Такая сопряженная реакция термодинамически возможна.
= -17,2 кДж/моль. Такая сопряженная реакция термодинамически возможна.
Последовательно рассматривая все стадии гликолиза, можно увидеть, что расход АТФ на одних стадиях компенсируется их образованием на других. Одна из причин, по которой АТФ играет исключительную роль в биохимических реакциях в том, что значение 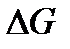 при гидролизе АТФ не очень большое (иначе для ее синтеза требовалось бы очень много энергии), и не очень маленькое (иначе АТФ не могло быть источником энергии для организма).
при гидролизе АТФ не очень большое (иначе для ее синтеза требовалось бы очень много энергии), и не очень маленькое (иначе АТФ не могло быть источником энергии для организма).
Итак, первый закон термодинамики позволяет количественно оценить энергетические характеристики процессов. Второй закон определяет, возможен или невозможен тот или иной процесс, и в каком направлении он будет протекать. Он утверждает, что все процессы самопроизвольно могут протекать только в одном направлении – стремясь к состоянию равновесия.
5. Химическая кинетика – учение о скоростях и механизмах химических реакций. Основное понятие кинетики – скорость химической реакции (vх.р.).
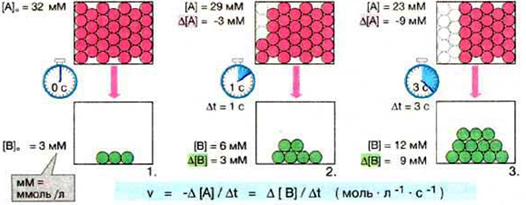 Скорость химической реакции определяется числом частиц, прореагировавших за единицу времени в единице объема. Т.к. число частиц мы выражаем величиной «количество вещества», а количество вещества в единице объема (
Скорость химической реакции определяется числом частиц, прореагировавших за единицу времени в единице объема. Т.к. число частиц мы выражаем величиной «количество вещества», а количество вещества в единице объема (  ) – это молярная концентрация, то можно сказать, что скорость - это изменение концентрации вещества за единицу времени.
) – это молярная концентрация, то можно сказать, что скорость - это изменение концентрации вещества за единицу времени. 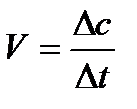
От чего зависит скорость химической реакции? Чтобы ответить на этот вопрос надо понимать, что для того чтобы реакция произошла, надо чтобы частицы реагирующих веществ столкнулись. Чем больше частиц в единице объема, тем вероятнее их столкновения. Чем больше их скорость, тем тоже вероятнее их столкновения. Т.е. скорость зависит от концентрации исходных веществ, возможности их свободного передвижения и температуры.
Дата добавления: 2021-02-19; просмотров: 705;











