Аморфные и кристаллические тела.
В аморфных телах существует ближний порядок расположения атомов. Кристаллы обладают дальним порядком расположения атомов. Аморфные тела изотропны, кристаллические – анизотропны.
При охлаждении и нагревании кривые зависимости температуры от времени различны для аморфных и кристаллических тел. Для аморфных тел переход из жидкого в твёрдое состояние может быть десятки градусов. Для кристаллов температура плавления постоянна. Возможны случаи, когда одно и тоже вещество, в зависимости от условий охлаждения, может быть получено как в кристаллическом, так и в аморфном твёрдом состоянии. Например, стекло при очень медленном охлаждении расплава может кристаллизоваться. При этом на границах мелких образующихся кристаллов будет происходить отражение и рассеяния света, и закристаллизованное стекло теряет прозрачность.
Кристаллическая решётка. Основным свойством кристаллов является регулярность расположения в них атомов. О совокупности точек, в которых расположены атомы (точнее атомные ядра), говорят как о кристаллической решётке, а сами точки называются узлами решётки.
Основной характеристикой кристаллической решётки является пространственная периодичность её структуры: кристалл как бы состоит из повторяющихся частей (ячеек).
Мы можем разбить кристаллическую решётку на совершенно одинаковые параллелепипеды, содержащие одинаковое количество одинаково расположенных атомов. Кристалл представляет собой совокупность параллелепипедов, параллельно сдвинутых по отношению друг к другу. Если сместить кристаллическую решётку параллельно самой себе на расстояние длины ребра, то решётка совместится сама с собой. Эти смещения называются трансляции, а симметрии решётки по отношению к этим смещениям говорят как о трансляционной симметрии (параллельный перенос, поворот относительно оси, зеркальное отражение и т.п.).
Если в вершине какой-либо элементарной ячейки находится атом, то такие же атомы должны, очевидно, находиться и во всех остальных вершинах этой и других ячеек. Совокупность одинаковых и одинаково расположенных атомов называется решёткой Браве данного кристалла. Она представляет как бы скелет кристаллической решётки, олицетворяющий собой всю её трансляционную симметрию, т.е. всю её периодичность.
Классификация различных типов симметрии кристаллов основывается, прежде всего, на классификации различных типов решёток Браве.
Наиболее симметричной решёткой Браве является решётка, имеющая симметрию куба (кубическая система). Существует три различных
| решётки Браве, относящихся к кубической системе: простая | 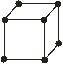
| , | |
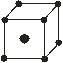
| объемно-центрированная (в центре куба – атом), гранецентрированная (кроме атомов в вершинах – ещё по атому в | ||
центрах всех их граней). Кроме кубической есть тетрагональная, ромбическая, моноклинная и другие (рассматривать не будем).
Решётка Браве, вообще говоря, не включает в себя всех атомов в кристалле. Реальная кристаллическая решётка может быть представлена как совокупность нескольких решёток Браве, вдвинутых одна в другую.
Физические типы кристаллов.
По роду частиц, из которых построена кристаллическая решётка, по характеру сил взаимодействия между ними, различают ионные, атомные, металлические и молекулярные кристаллы.
1. Ионные кристаллы. В узлах кристаллической решётки располагаются попеременно положительные и отрицательные ионы. Эти ионы притягиваются друг к другу электростатическими (кулоновскими) силами. Пример: решётка каменной соли  (рис. 11.1).
(рис. 11.1).
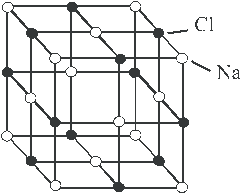
|
| Рис. 11.1 |
2. Атомные кристаллы. Типичными представителями являются графит и алмаз. Связь между атомами – ковалентная. В этом случае каждый из валентных электронов входит в электронную пару, связывающую данный атом с одним из соседей.
3. Металлические кристаллы. Решётки состоят из положительно заряженных ионов, между которыми находятся “свободные” электроны. Эти электроны ”коллективизированы“ и могут рассматриваться как своего рода ”электронный газ“. Электроны играют роль “цемента”, удерживая “+” ионы, иначе решётка распалась бы. Ионы же удерживают электроны в пределах решётки.
4. Молекулярные кристаллы. Примером является лёд. В узлах – молекулы, которые связаны между собой силами Ван-дер-Ваальса, т.е. силами взаимодействия молекулярных электрических диполей.
Могут быть одновременно несколько видов связей (например, в графите – ковалентная, металлическая и Ван-дер-Ваальсовская).
Дефекты в кристаллах.
В реальных кристаллических решётках существует отклонения от идеального расположения атомов в решётках, которые мы до сих пор рассматривали. Все такие отклонения называются дефектами кристаллической решётки.
Точечные дефекты – такие, при которых нарушается ближний порядок:
| 1 – отсутствие атома в каком-либо узле (вакансия) (рис. 11.2); | 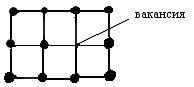
|
| Рис. 11.2 | |
| 2 – замена своего атома “чужими” (рис. 11.3); | 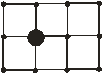
|
| Рис. 11.3 | |
| 3 – внедрение своего атома или чужого в межузельное пространство (рис. 11.4) | 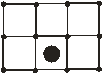
|
| Рис. 11.4 |
Другой вид дефектов – дислокации – линейные дефекты кристаллической решётки, нарушающие правильное чередование атомных плоскостей. Они нарушают дальний порядок, искажая всю его структуру. Они играют важную роль в механических свойствах твёрдых тел. Простейшие типы дислокаций краевая и винтовая. В случае краевой дислокации лишняя кристаллическая плоскость вдвинута между соседними слоями атомов (рис. 11.5).
В случае винтовой дислокации часть кристаллической решётки сдвинута относительно другой (рис. 11.6)
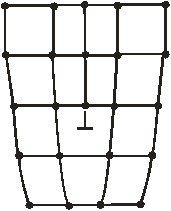
| 
| |
| Рис. 11.5 | Рис 11.6 |
Дата добавления: 2016-12-27; просмотров: 1619;











