Относительные электроотрицательности некоторых элементов.
| Период | Группа | ||||||
| I | II | III | IV | V | VI | VII | |
| Н 2,1 | |||||||
| Li 0,98 | Be 1,5 | В 2,0 | С 2,5 | N 3,07 | О 3,50 | F 4,0 | |
| Na 0,93 | Mg 1,2 | Al 1,6 | Si 1,9 | P 2,2 | S 2,6 | Cl 3,0 | |
| К 0,91 | Са 1,04 | Ga 1,8 | Ge 2,0 | As 2,1 | Se 2,5 | Br 2,8 | |
| Rb 0,89 | Sr 0,99 | In 1,5 | Sn 1,7 | Sb 1,8 | Те 2,1 | I 2,6 |
Ковалентная связь может образоваться между двумя атомами, из которых один имеет пару электронов, а другой — свободную орбиталь. Например, при взаимодействии аммиака NH3 и хлороводорода НCl.
NH3 + НCl ® 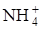 + Cl–
+ Cl–
В молекуле аммиака атом азота имеет неподеленную пара s-электронов. ЭО (N) = 3,07 эВ, ЭО(Н) = 2,1 эВ.
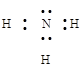
У иона водорода свободна 1s-орбиталь.
Неподеленная пара электронов атома азота становится общей для водорода и азота, получается ион аммония 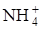
 N 1s22s22p3 H+
N 1s22s22p3 H+
p s
s
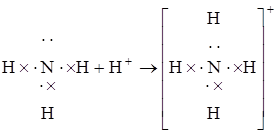
Такой механизм образования ковалентной связи называется донорно-акцепторным. Атом, предоставляющий неподеленную электронную пару называется донором (атом азота), а атом, принимающий ее, – акцептором (ион водорода).
Дата добавления: 2016-10-26; просмотров: 1350;











