Расчеты по химическим уравнениям
Задание. Сколько литров кислорода (н. у.) вступит в реакцию при сгорании 4,8 г магния?
| Дано: m(Mg) = 4,8 г | Решение:
а) запишем уравнение реакции:
2Mg + O2 = 2MgO
б) определим количество вещества магния, которое вступило в реакцию с кислородом:
n(Mg) = 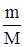 = = 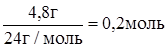 .
в) Согласно уравнению реакции
n(O2) = .
в) Согласно уравнению реакции
n(O2) = 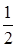 n(Mg) = 0,1 моль.
г) Определим объем кислорода: n(Mg) = 0,1 моль.
г) Определим объем кислорода:
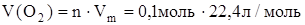 = 2,24 л. = 2,24 л.
| |
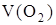 - ?(н.у.) - ?(н.у.)
| ||
| Ответ: 2,24 л кислорода. |
Периодический закон (ПЗ) и периодическая система (ПС)
элементов Д. И. Менделеева
Открытие ПЗ и построение ПС явились вершиной развития химии в 19 в (1869 г). Д.И. Менделеев расположил все известные в то время элементы (63) в порядке возрастания их атомных масс и при этом обнаружил связь свойств химических элементов с их атомными массами, которая заключалась в том, что через определенные интервалы свойства элементов повторялись. Д. И. Менделеев сформулировал периодический закон так: Свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных масс элементов.
Несмотря на всю огромную значимость такого вывода, ПЗ и ПС представляли лишь гениальное эмпирическое (экспериментальное) обобщение фактов, а их физический смысл долгое время оставался непонятным. Причина этого в том, что в 19 в совершенно отсутствовали представления о сложности строения атома.
Чаще используют три варианта ПС:
1. Короткопериодный;
2. Полудлинный (все элементы 4-го и 5-го периодов вытянуты в одну линию по 18 элементов;
3. Длиннопериодный (в одну линию вытянуты все s, p, d и f элементы.
Короткаяформа ПС состоит из 7 периодов и 8 групп.
Период – это горизонтальный ряд, который начинается щелочным металлом (кроме первого периода) и заканчивается инертным элементом (кроме седьмого периода).
Первый, второй и третий периоды состоят из одного ряда и называются малыми. Четвертый, пятый и шестой периоды состоят из двух рядов и называются большими. Всего в периодической системе 10 рядов. Верхний ряд - четный, нижний - нечетный. Четные ряды содержат только металлы и свойства элементов слева направо меняются мало. Четный ряд большого периода заканчивается тремя сходными между собой по свойствам элементами: триадами. Нечетные ряды содержат металлы и неметаллы, в них слева направо идет постепенный переход от металлических свойств к неметаллическим.
В шестом периоде послелантана La (№ 57) расположены 14 элементов со сходными свойствами(№ 58 - 71): лантаноиды. Все они реакционноспособные металлы, реагируют с водой, у них сильно выражена горизонтальная аналогия.
В седьмом периоде после актиния Ас (№89) аналогично расположены14 элементов (№90 - 103), подобных актинию: актиноиды.Ядра их атомов крайне неустойчивы, то есть являются радиоактивными.
Каждая группа состоит из двух подгрупп: главной и побочной.
Подгруппы, в которые входят элементы малых и больших периодов, называются главными (А). Подгруппы, в которые входят элементы только больших периодов, называются побочными (В). Подгруппы объединяют наиболее сходные между собой элементы.
Для элементов одной группы характерны следующие закономерности:
1. Все элементы, кроме благородных газов, образуют кислородные соединения.
2. Высшая валентность и высшая положительная степень окисления обычно соответствует номеру группы. Исключения: 1) в 8-й группе только у рутения Ru и Os валентность равна VIII; Cu+1, Cu+2; O–2; F–1.
3. Элементы главной подгруппы с IV по VIII группы образуют летучие соединения с водородом. Валентность их в этих соединениях равна разности между числом 8 и номером группы. Например, N находится в V-й группе и его валентность равна 8 – 5 = 3 в соединении NH3.
Строение атома
В XIX в. считали, что атом – неделимая частица, которая не изменяется при химических реакциях. В концеХIХ- начале XX вв. были открыты рентгеновское излучение (немецким ученым К. Рентгеном, 1895 г), радиоактивность (французским ученым А. Беккерелем, 1896), электрон (английским ученым Дж. Томсоном, 1897 г.). Масса m(е)=9,109×10–28г и отрицательный заряд q(e)=1,602×10–19Кл. Величина заряда электрона принята за единицу элементарного электрического заряда.
В 1903 г. Дж. Томсон предложил модель строения атома, согласно которой положительный заряд равномерно распределен по объему атома и нейтрализован вкрапленными в него электронами. Развивая эти представления, Э. Резерфорд в 1911г. предложил планетарную модель строения атома. По этой теории в центре атома находится положительно заряженное ядро, вокруг которого движутся электроны. Совокупность электронов в атоме называется его электронной оболочкой. В 1913 г. Английский ученый Д. Мозли обнаружил, что величина положительного заряда ядра атома равна порядковому номеру элемента в периодической системе элементов Д. И. Менделеева. Атом электронейтрален, следовательно, число электронов в электронной оболочке атома равно заряду ядра Z или порядковому номеру элемента в периодической системе.
В 1932 г. советские ученые Д. Д. Иваненко и Е. Н. Гапон и, независимо от ниx, немецкий ученый В. Гейзенберг создали протонно-нейтронную теорию строения ядра. Протон р - это частица с массой, равной 1 а. е. м.
(1,66 ×10–24 г), и зарядом + 1. Нейтрон n – это электронейтральная частица массой, близкой к массе протона. Протоны и нейтроны называют нуклонами.
Заряд ядра атома определяется числом протонов. Следовательно, число протонов в ядре атома также равно порядковому номеру элемента в периодической системе. Общее число протонов и нейтронов называется массовым числом (А). Оно равно округленному до целого числа значению относительной атомной массы.
Ar = р + n,
Задание. Какой заряд ядра и сколько электронов, протонов, нейтронов в атоме цинка?
Z=+30, p=30, e=30, n = 65–30 = 35.
Изотопы
Разновидности атомов одного элемента, обладающие одинаковыми зарядами ядер, но разными массовыми числами (одинаковым числом протонов и разным числом нейтронов), называются изотопами. Химические свойства всех изотопов одного элемента одинаковы.
Каждый изотоп характеризуется двумя величинами: массовым числом (проставляется вверху слева от химического знака) и порядковым номером (проставляется внизу слева от химического знака) и обозначается символом соответствующего элемента. Например, элемент водород имеет три изотопа. 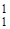 Н – протий (1 р);
Н – протий (1 р); 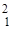 D (
D ( 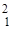 Н) - дейтерий (1р, 1 n);
Н) - дейтерий (1р, 1 n); 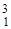 T (
T ( 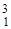 Н) - тритий (1 р, 2 n).
Н) - тритий (1 р, 2 n).
Задание.Сколько протонов и нейтронов содержат ядра изотопов 36Ar, 38 Ar, 40Ar?
36–18 = 18; 38 – 18 = 20; 40 – 18 = 22.
Относительная атомная масса элемента в периодической системе элементов Д. И. Менделеева - это среднее арифметическое масс атомов его изотопов с учетом их распространенности в природе.
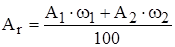
Например, природный хлор - это смесь 77,4% изотопа 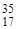 С1 и 22,6% изотопа
С1 и 22,6% изотопа 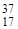 Сl. Поэтому
Сl. Поэтому
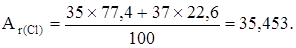
Задание. Медь состоит из изотопов 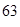 Cu и
Cu и 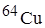 . Сколько процентов каждого изотопа содержится в меди, если
. Сколько процентов каждого изотопа содержится в меди, если 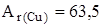 46?
46?
w( 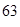 Cu)=х%, w(
Cu)=х%, w( 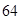 Cu)=(100–х)%,
Cu)=(100–х)%,
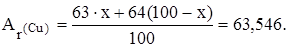
6354,6=63х+6400–64х
х=6400–6354,6, х = 45,4; w( 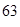 Cu)= 45,4%.
Cu)= 45,4%.
w( 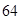 Cu)=100–45,4=54,6%,
Cu)=100–45,4=54,6%,
Дата добавления: 2016-10-26; просмотров: 1608;











