Направленность связи
Образование ковалентной связи является результатом перекрывания валентных электронных облаков (атомных орбиталей АО), которые характеризуются определенными ориентациями в пространстве, и поэтому ковалентная связь имеет строго определенную направленность.
Направление ковалентных связей характеризуется валентными углами – углами между линиями, соединяющими центры связываемых атомов. Сама по себе графическая формула молекулы или иона не несет информации о валентных углах. Например, в ионе [SO4 ]2− валентные углы между связями S-O равны 109,5o, а в ионе [PdCl4]2− Pd-Cl − 90o; молекула ВF3 – плоская треугольная, NF3 – пирамидальная, а С1F3 имеет Т-образную форму, хотя все три последние молекулы имеют состав АF3.
Совокупность длин связей и валентных углов в молекуле определяет ее пространственное равновесное строение, в котором имеет место равенство сил
притяжения и отталкивания и которое обеспечивает оптимальное пространственное строение и минимальное значение энергии молекулы.
Перекрывание атомных орбиталей вдоль линии, связывающей ядра атомов, приводит к образованию σ-связей. Между двумя атомами в химической частице возможна только одна σ-связь. Все σ-связи обладают осевой симметрией относительно межъядерной оси.
Фрагменты химических частиц могут вращаться вокруг межъядерной оси без нарушения степени перекрывания атомных орбиталей, образующих σ-связи.
Совокупность направленных, строго ориентированных в пространстве σ - связей создает пространственную структуру частиц.
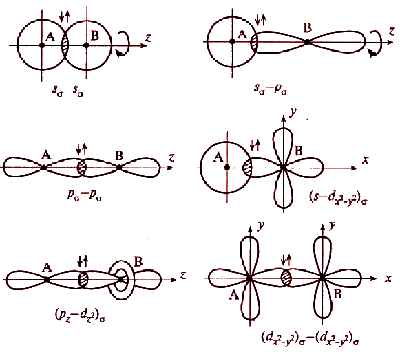
Рис. 4.2. Схемы образования σ-связей с участием электронов различных типов
При дополнительном перекрывании атомных орбиталей, перпендикулярных линии связывающей ядра взаимодействующих атомов, образуются π-связи, в которых могут принимать участие р- р, р - d и d-d-орбитали (рис.4.3).
С появлением π-связи, не имеющей осевой симметрии, свободное вращение фрагментов химической частицы вокруг σ-связи становится невозможным, так как оно должно привести к разрыву π-связи.
Число связей, образующихся между атомами, называется кратностью, или порядком связи, и определяется числом общих электронных пар.
Установлено, что среднее расстояние между связанными атомами (длина связи) уменьшается с возрастанием числа обобществленных электронных пар.
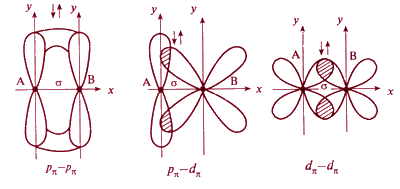
Рис. 4.3. Схемы образования π-связей с участием электронов различных типов
Это связано с тем, что электронная плотность между двумя положительно заряженными ядрами возрастает, вследствие чего увеличивается и притяжение между ядрами, а следовательно, возрастает и энергия связи (табл. 4.2).
Таблица 4.2.
Дата добавления: 2021-01-26; просмотров: 514;











