Возможно ли образование фосфиноксида в живой клетке? И во что он может превращаться?
Конечно, аргументация в пользу образования фосфиноксида в живых системах имеет вес только в том случае, если известно возникновение сходных интермедиатов в результате ферментативных реакций. И такие примеры есть. Например, бактерия Eubacterium acidaminophilum, специализирующаяся на сбраживании аминокислот, содержит мультиферментный комплекс глицинредуктазу, превращающую аминокислоты глицин, саркозин и бетаин в ацетилфосфат [160-162]. Ключевым полупродуктом данного превращения является кетен (карбометилен) Н2С=С=О, сильнейший ацетилирующий агент, по реакционной способности мало уступающий фосфиноксиду, а токсическим воздействием сравнимый с фосгеном. В состав мультифермента входит селенобелок. В кислой среде от остатка Se-карбоксиметилселеноцистеина, входящего в активный центр, отделяются молекулы кетена и воды, с образованием связи S-Se (рис. 4). После этого кетен моментально присоединяется к сульфгидрильной группе цистеина ацетилтрансферазы, образуя S-ацетилцистеин. Поскольку образующийся кетен не покидает активный центр мультифермента, он не наносит вред клетке. Таким образом, глицинредуктазу можно уподобить чрезвычайно совершенному химическому заводу, не производящему вредные выбросы в окружающую среду, а сам кетен можно считать природным веществом.
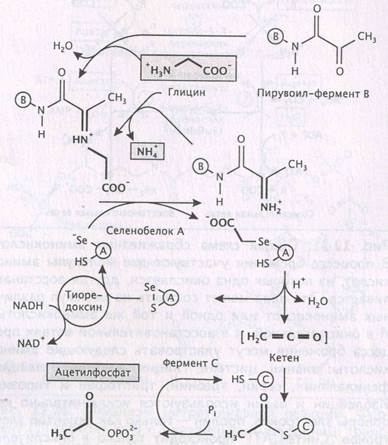
Рис. 4. Механизм действия мультиферментного комплекса E. acidaminophilum, включающий образование высокореакционноспособного интермедиата кетена, по [162].
Предположение о метаболизме фосфина в «реактивные окисленные интермедиаты», к которым относится фосфиноксид, делается также и на страницах [163]. При этом дается указание на интересную возможность присоединения этого электрофильного агента к биологическим нуклеофилам, с образованием аддуктов. Известно, что образование аддуктов с биополимерами, в первую очередь, азотистыми основаниями ДНК – довольно частая причина мутаций. Склонные образовывать их вещества (напрямую, или опосредованно, через образование активных метаболитов) – известные мутагены и канцерогены [164, 165]. Таковы, например, формальдегид, винилхлорид и тетрахлорэтилен (и их химически агрессивные метаболиты хлорэтиленоксид, трихлорацетилхлорид, дихлортиокетен) [166, 167, 228], азиридин, β-лактоны и циклопропаны [165, 168-171], ацетальдегид – основной метаболит этилового спирта [172], акролеин и другие ненасыщенные альдегиды [173-175], глиоксаль и прочие диальдегиды [176-178], хлоральгидрат и его метаболиты [179], метаболит н-гексана 2,5-гександион [180], акрилонитрил [189], цианаты и изоцианаты [192, 193], ненасыщенные и ароматические углеводороды [181, 189, 190, 199-202], анилин и другие ариламины [182, 183], аристолоховая кислота [184], стероидные гормоны [185], ряд гетероциклических соединений [186-189], эндогенные продукты перекисного окисления липидов [194-198], диазосоединения [204], азоксиметан [205], нитраты, нитриты, пероксинитриты, нитрозамины и гидроксиламины [203, 205, 207], гидразины [165, 208], аминокислота азидоаланин – метаболит неорганического азида [209, 210], карбодиимиды [211], свободный гидроксильный радикал [212, 213], озон [214], пирролизидиновые алкалоиды [215], алкалоиды в составе бетеля (ареколин, гуваколин, и гувацин) [216], антибиотик неокарциностатин, его природные и синтетические аналоги [37, 217-219], афлатоксин и ацетаминофен [220], митомицин С [221], ятакемицин [222], тиоацетамид [223], диметилсульфат [224], метилфторсульфат («магический метил», самый сильный известный метилирующий агент) [225], этилметансульфонат [226], метилгалогениды [227], 1,2-дигалоэтаны, 1,2,3-тригалопропаны и трис(2,3-дигалоалкил)фосфаты [228-230], эпихлоргидрин [231, 232], этиленоксид [233], дихлорацетилен [234], хлорпикрин и бромциан [235, 236], фурфуриловый спирт [237], уксусный ангидрид [238], фосген [239], галогены [240], ряд соединений платины, в том числе цисплатин [241], фуллерен С60 [242], иприты, циклофосфамид, и представители некоторых других классов соединений [243-245]. В работах [246-248] сообщается о том, что фосфин тоже является мутагеном, ему присуща генотоксичность! Более того, это свойство обнаружено у предшественника фосфина фосфида цинка [249, 250]. Мутагенные свойства фосфина сами по себе являются весомым аргументом в пользу гипотезы об образовании активного интермедиата, вступающего в реакции присоединения. Впрочем, как в [154], так и в [163] указывается на то, что метаболизм фосфина в фосфиноксид не более чем гипотеза, хотя и вполне обоснованная: будучи чрезвычайно реакционноспособным, он не был обнаружен в биологических тканях. У элементов углерода и фосфора, расположенных в Периодической таблице по диагонали, существует выраженное диагональное сходство свойств. Соответственно, свойства фосфиноксида должны быть сходны со свойствами его углеродного аналога формальдегида Н2С=О, весьма склонного к реакциям присоединения и (как уже упоминалось выше) образованию аддуктов с основаниями ДНК.
Известно, что фосфиноксиды легко вступают в реакции присоединения с карбонильными соединениями – кетонами и альдегидами – с образованием соответствующих α-гидроксиалкилфосфиноксидов [251]. Можно предположить, что в живой клетке фосфиноксид может присоединяться к карбонильным группам сахаров. Продуктами дальнейшего метаболического окисления таких аддуктов могут быть фосфоносахара (производные оксофосфинанов «фостины», аналоги пираноз, и «фостоны», аналоги фураноз) [252]. Данные вещества, в настоящее время не известные в природе, являются цитотоксинами и рассматриваются как потенциальные противораковые препараты [252, 253]. Будучи структурными аналогами фосфорилированных сахаров, они при помощи фермента тимидилилтрансферазы могут присоединяться к дезоксириботимидилтрифосфату, образуя аномальный нуклеотид, содержащий вместо сахара фосфоносахар и нарушающий углеводный обмен (рис. 5) [253]. Это один из возможных путей токсического действия фосфина и фосфиноксида, хотя и не обнаруженный экспериментально.
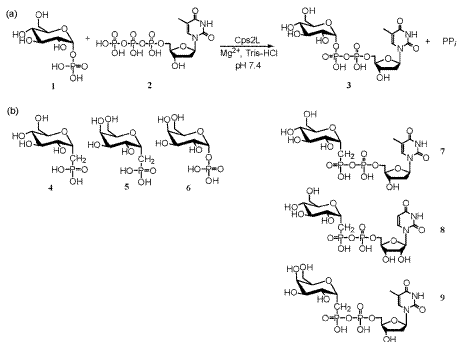
Рис. 5. (а) нормальная реакция, катализируемая тимидилилтрансферазой Cps2L, ведущая к образованию дезоксириботимидиндифосфатглюкозы. 1 α-D-глюкозо-6-фосфат, 2 дезоксириботимидилтрифосфат. (б) аномальные нуклеотиды 7, 8 и 9, образовавшиеся при замене глюкозо-6-фосфата на галактозо-6-фосфат 6, либо синтетические фосфоносахара 4 и 5. По [253].
Замещенные фосфиноксиды в живых организмах образуются!
В старой, ставшей классической работе [254] предполагается, что фосфин в организме насекомых окисляется непосредственно в фосфорноватистую кислоту:
РН3 + О2 →Н3РО2
Однако, в этой работе возможность образования фосфиноксида in vivo не отрицается. Дело в том, что на момент написания этой работы (1975 год) фосфиноксид еще не был известен, его открыли десять лет спустя [255]. В работе [154] сообщается, что продуктами метаболизма фосфина у беспозвоночных являются фосфорноватистая и фосфористая кислоты – продукты дальнейшего окисления фосфиноксида. В трудах [256, 257] сообщается, что фосфин и фосфиды металлов в организме крыс окисляются до гипофосфита и фосфита (преобладает гипофосфит), которые выводятся с мочой. Фосфиты и гипофосфиты могут образовываться в результате дальнейшего окисления фосфиноксида, или параллельно ему, другим метаболическим путем. В пользу образования фосфиноксида in vivo говорит то, что для замещенных фосфинов, таких как трифенилфосфин, три-н-бутилфосфин, диэтилфенилфосфин и метилэтилфенилфосфин, уже известен окислительный метаболизм в соответствующие фосфиноксиды, культурами грибов Mortierella isabellina ATCC 42613, Helminthosporium species NRRL 4671, Aspergillus foetidusATCC 10254 [258]. В диссертации [259] сообщается о метаболическом окислении трифенилфосфина до трифенилфосфиноксида в организме млекопитающих. В статье [260] приводится интересное наблюдение ингибирования ферментов три-н-пропанолфосфином и три-2-карбоксиэтилфосфином: будучи сильными восстановителями, фосфины восстанавливают дисульфидные мостики в белках до сульфгидрильных групп, нарушая конформацию молекул, а сами окисляются при этом до соответствующих фосфиноксидов. В работе [261] сообщается про ферментативное (цитохромом Р450) окисление 3-диметиламинопропилдифенилфосфина до соответствующего N,P-диоксида. Аналогично, незамещенный фосфин восстанавливает каталитический дисульфидный мостик в дигидролипоамиддегидрогеназе беспозвоночных, хотя в работе не указывается продукт его окисления [262].
Подобное окисление характерно не только для соединений фосфора, но и других элементов главной подгруппы пятой группы. Так, придающий рыбам «рыбный» запах триметиламин окисляется в организме этих холоднокровных существ в триметиламиноксид, выполняющий роль криопротектора [263]. Причем окисление обратимо – ряд бактерий используют ТМАО в качестве дыхательного субстрата и восстанавливают обратно в ТМА [264]. Также наблюдалось окисление трифениларсина в трифениларсиноксид культурой гриба Trichodermaharzianum As 11 [265]. Диметилсульфид, образующийся при катаболизме распространенного в морских водорослях осмо- и криопротектора диметилсульфониопропионовой кислоты (ДМСП), ферментативно окисляется до диметилсульфоксида [266], причем опять-таки обратимо, ДМСО ряду бактерий служит дыхательным акцептором электронов [267]. Аналогично, и другие органические сульфиды окисляются до соответствующих сульфоксидов [268], а алканы – до 2-кетонов [269, 270]. Известно, что окисление фосфинов до фосфиноксидов заметно ускоряется в присутствии катализаторов - комплексов молибдена. Вполне возможно, что в живых клетках данная реакция осуществляется ферментами с молибден-птериновыми активными центрами. Именно такие ферменты осуществляют превращения ТМАО и ДМСО [271]. Окисление фосфинов в соответствующие фосфиноксиды отлично укладывается в общую схему метаболизма ксенобиотиков, направленного на увеличение их полярности и гидрофильности, облегчающее их выведение из организма [272-274]. Следует, однако, иметь ввиду, что алкил- и арилфосфиноксиды являются значительно более устойчивыми соединениями, чем незамещенный фосфиноксид [275]. Поэтому экстраполировать результаты следует с большой осторожностью.
Дата добавления: 2019-09-30; просмотров: 906;











