ФОСФОРНЫЕ УДОБРЕНИЯ
К фосфорным удобрениям относятся простой и двойной суперфосфат, принадлежащий к классу водорастворимых удобрений.
Сырье. Для производства элементного фосфора, фосфорной кислоты, фосфорных удобрений и других соединений фосфора служат природные фосфаты: апатиты и фосфориты. В этих соединениях фосфор находится в нерастворимой форме, главным образом в виде фторапатита Ca5F(PO4)3 или трикальцийфосфата Са3(РО4)2.
Апатит — минерал, входящий в состав изверженных пород. На Кольском полуострове имеются крупнейшие залежи апатитонефелиновой породы. Нефелин (К, Na)2O×Al2O3×2SiO2×2H2O — сырье алюминиевой промышленности. Апатитонефелиновую породу, содержащую до 70% апатита и до 25% нефелина, разделяют флотацией на апатитовый концентрат, в состав которого входит до 40% Р2О5, и нефелиновую фракцию, которая после повторного обогащения содержит до 30% А12О3.
Фосфориты — породы осадочного происхождения. Содержание Р2О5 в фосфоритах колеблется от 20 до 30%. Некоторая часть фосфоритов в виде так называемой фосфоритной муки используется в качестве удобрения для кислых подзолистых почв.
Для получения усваиваемых растениями удобрений, применяемых на любых почвах, нужно перевести нерастворимые природные фосфаты в водорастворимые или легко усваиваемые соли. Растворимость фосфатных солей повышается с увеличением их кислотности. Средняя соль Са3(РО4)2 растворима лишь в сильных минеральных кислотах, СаНРО4 растворяется уже в органических кислотах почвы, а наиболее кислая соль — Са(Н2РО4)2 — растворима в воде. Перевод нерастворимых природных солей в растворимые осуществляется разложением их кислотами или нагреванием (например, термическая возгонка фосфора).
Производство суперфосфата. Химическая промышленность выпускает простой суперфосфат, представляющий собой в основном смесь Са(Н2РО4)2 и CaSO4, а также двойной суперфосфат — Са(Н2РО4)2×Н2О.
Сущность производства простого суперфосфата заключается в сернокислотном разложении фторапатита, которое представляет собой сложный, многофазный гетерогенный процесс, осуществляемый согласно общему уравнению реакции
2Ca5F(РО4)3 + 7H2SO4 + 3Н2О ® 3Са (Н2РО4)2×Н2О + 7CaSO4 + 2HF
В действительности процесс разложения протекает в две стадии. Первая стадия — это реакция обменного разложения, которая идет на поверхности твердых частиц фосфата при избытке серной кислоты, в результате чего образуется свободная фосфорная кислота:
2Ca5F(РО4)3 + 10H2SO4 +5Н2О ® 6Н3РО4 + 10CaSO4×0,5H2O + 2HF (I)
Эта реакция начинается сразу же после смешения фосфата с серной кислотой и заканчивается через 20—40 мин. При этом температура в реакционном пространстве поднимается до 110—120 °С. После полного израсходования серной кислоты протекает вторая стадия процесса — разложение оставшегося фосфата накопившейся фосфорной кислотой по уравнению реакции
Ca5F(РО4)3 + 7Н3РО4 + 5H2O ® 5Са(Н2РО4)2×Н2О + HF (II)
Образующийся монокальцийфосфат находится сначала в растворе, при перенасыщении которого начинает кристаллизоваться. Вторая стадия процесса, называемая созреванием суперфосфата, протекает очень медленно. Скорость ее зависит от применяемого сырья и условий процесса и может продолжаться от 6 до 25 сут. Созревание начинается еще в реакционной суперфосфатной камере, затем процесс продолжается на складе, где суперфосфат вылеживается, перемешивается и при этом дозревает. Дозревание ускоряется с понижением температуры и удалением влаги, в результате чего ускоряется кристаллизация монофосфата кальция и повышается концентрация Н3РО4, реагирующей с оставшимся Ca5F(PO4)3 по реакции (II). Для ускорения дозревания суперфосфата на складе его периодически перемешивают грейферным краном. Наиболее ответственная стадия производства — это приготовление суперфосфата в камере, которое представляет собой сложный гетерогенный процесс, включающий наряду с химическими реакциями более медленные: диффузию фосфорной кислоты внутрь неразложившегося фосфата и кристаллизацию монокальцийфосфата. К основным факторам, определяющим скорость созревания, а также влияющим на структуру и физические свойства суперфосфата, относятся температура в камере и концентрация серной кислоты. Влияние концентрации серной кислоты на степень разложения фосфатов (степень превращения) представлено на рис. 1.
| |
| |
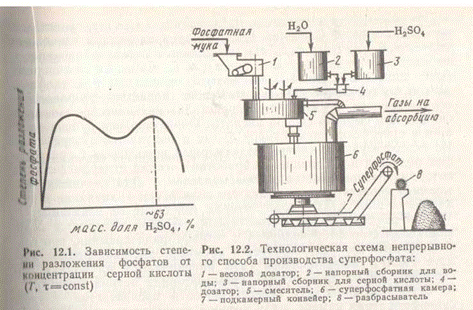
Положение максимумов зависит от вида сырья, соотношения Т : Ж, температуры, времени процесса и др. Скорость и степень разложения фосфата кислотой низкой концентрации (левый максимум) высоки, но с кислотой низкой концентрации вводится большое количество воды и вместо твердого суперфосфата получается несхватывающаяся пульпа. Второй максимум соответствует примерно 63%-ной серной кислоте. При использовании более концентрированной кислоты жидкая фаза быстро пересыщается сульфатом кальция, и он кристаллизуется из раствора в виде мельчайших кристалликов, оседающих на поверхности зерен фосфата в виде плотной корки, препятствующей дальнейшей диффузии кислоты внутрь зерна.
Технологическая схема производства суперфосфата складывается из четырех операций: 1) дозировки серной кислоты и апатитового концентрата; 2) смешения реагентов в смесителе с получением пульпы; 3) схватывания и затвердевания суперфосфатной массы в реакционной камере и 4) дозревания суперфосфата на складе.
На рис 2. представлена принципиальная схема производства суперфосфата. Системой транспортеров, шнеков и элеватором апатитовый концентрат со склада подается в весовой дозатор 1, из которого он дозируется в смеситель 5. Сюда же из напорных баков для серной кислоты 3 и воды 2 через дозатор 4, снабженный автоматическим концентратомером, подается разбавленная серная кислота. В смесителе 5 происходит механическое смешение фосфатного сырья и серной кислоты. Образующаяся пульпа подается в суперфосфатную камеру 6, где и получается суперфосфат. Из суперфосфатной камеры подкамерным конвейером 7 суперфосфат подается в отделение дообработки — склад суперфосфата, по которому распределяется разбрасывателем 8. Для улучшения физических свойств суперфосфата его подвергают грануляции в специальных аппаратах — грануляторах (на схеме не показаны).
При разложении фосфатов серной кислотой выделяется большое количество фтороводорода и тетрафторида кремния, при взаимодействии которых образуется кремнефтористоводородная кислота H2SiF6. Выделившиеся газы направляются на водную абсорбцию или на производство кремнефторида натрия Na2SiF6.
Основным аппаратом суперфосфатного производства служит суперфосфатная камера, план которой приведен на рис. 3.
| |
 Он представляет собой вертикальный железобетонный цилиндр 1, который вместе с железобетонным днищем медленно вращается вокруг неподвижной полой чугунной трубы 2, предназначенной для выгрузки суперфосфата из камеры. В зону загрузки через люк в крышке камеры непрерывно поступает суперфосфатная пульпа. В зоне выгрузки у перегородки находится фрезер 3, вращающийся в направлении, противоположном вращению камеры. Готовый суперфосфат срезается ножами фрезера и через полую центральную трубу выгружается из камеры.
Он представляет собой вертикальный железобетонный цилиндр 1, который вместе с железобетонным днищем медленно вращается вокруг неподвижной полой чугунной трубы 2, предназначенной для выгрузки суперфосфата из камеры. В зону загрузки через люк в крышке камеры непрерывно поступает суперфосфатная пульпа. В зоне выгрузки у перегородки находится фрезер 3, вращающийся в направлении, противоположном вращению камеры. Готовый суперфосфат срезается ножами фрезера и через полую центральную трубу выгружается из камеры.
Основным недостатком простого суперфосфата является относительно низкое содержание Р2О5 в удобрении. Для получения более концентрированного фосфорного удобрения разложение природных фосфатов производят 70%-ной фосфорной кислотой. При этом образуется так называемый двойной суперфосфат, производство которого быстро возрастает. Двойной суперфосфат в отличие от простого состоит в основном из монокальцийфосфата и содержит 40—50% Р2О5, т. е. в 2—3 раза больше, чем простой, и относится к более ценным безбалластным удобрениям.
Таким образом, для производства двойного суперфосфата требуется фосфорная кислота. Существует два способа получения фосфорной кислоты — электротермический и экстракционный. Электротермический способ основан на восстановлении фосфора из фосфатов в электродуговых печах с последующим окислением элементного парообразного фосфора (Р4) до его оксида
и растворения последнего в воде. Таким способом получают концентрированную чистую фосфорную кислоту, как правило, не используемую в производстве суперфосфата. Для его получения применяется экстрационная фосфорная кислота, т. е. извлеченная из природных фосфатов воздействием минеральных кислот, обычно серной. Суть сернокислотного извлечения (экстракции) Н3РО4 из природных фосфатов состоит в обработке их тонких порошков избытков серной кислоты.
Получающуюся фосфорную кислоту отделяют от фосфогипса на барабанных вакуум-фильтрах. Поскольку таким методом можно получить только сильно разбавленную (30—35%) кислоту, ее подвергают концентрированию упариванием.
АЗОТНЫЕ УДОБРЕНИЯ
Азотные удобрения подразделяют на аммиачные, содержащие азот в виде катиона NH4+, нитратные, содержащие азот в виде аниона NО3–, аммиачно-нитратные, содержащие оба иона, и амидные, содержащие азот в форме NH2. Наиболее распространены в СССР азотные удобрения: нитрат аммония и карбамид (мочевина).
Большинство азотных удобрений получают нейтрализацией кислот щелочами. В качестве примера можно рассмотреть производство основных азотных удобрений — аммиачной селитры и карбамида.
ПРОИЗВОДСТВО АММИАЧНОЙ СЕЛИТРЫ
Аммиачная селитра — нитрат аммония NH4NO3 — производится в огромных количествах, поскольку является не только концентрированным азотным удобрением, но широко применяемым взрывчатым веществом.
Как азотное удобрение аммиачная селитра представляет собой безбалластное удобрение, содержащее 35% азота в аммиачной и нитратной формах. Аммиачная селитра может быть использована как удобрение для любых культур и любых почв. Однако это удобрение имеет плохие физические свойства: кристаллы NH4NO3 сильно гигроскопичны и потому, расплываясь на воздухе, слеживаются затем при хранении в крупные агломераты, которые очень трудно вносить в почву. Для уменьшения слеживаемости селитры ее гранулируют с некоторыми негигроскопичными добавками (нитраты кальция и магния, фосфаты кальция); полученные гранулы припудривают тонкомолотым гипсом, каолином, фосфоритной или костяной мукой. Кроме того, нитрат аммония огне- и взрывоопасен, что также осложняет применение его в качестве удобрения. Как правило, нитрат аммония выпускают заводы, производящие аммиак и азотную кислоту.
Процесс производства аммиачной селитры складывается из нейтрализации разбавленной азотной кислоты газообразным аммиаком: NH3 + HNO3 ®NH4NO3, ΔН = –149 кДж,
упарки полученного раствора и грануляции нитрата аммония. Взаимодействие газообразного аммиака и азотной кислоты — типичный хемосорбционный процесс, протекающий в диффузионной области, поскольку само химическое взаимодействие компонентов протекает крайне быстро.
В настоящее время наиболее распространены схемы с частичным выпариванием раствора за счет теплоты нейтрализации. Схема такой установки приведена на рис. 4. Схема производства аммиачной селитры характеризуется отсутствием жидкостных выбросов. Газовые же потоки оказываются открытыми. Так, в грануляционной башне образуется газопылевая смесь, для очистки которой от пыли селитры используют тарельчатые скрубберы, орошаемые слабым раствором NH4NO3. Сюда же для очистки поступает соковый пар из реактора-нейтрализатора и выпарного аппарата. Схема снабжена автоматическим регулированием расхода реагентов, температуры и рН среды после нейтрализации и выпарки, а также автоматической системой блокировки, прекращающей поступление растворов на выпарку и плава на грануляцию при нарушении параметров режима.
| |
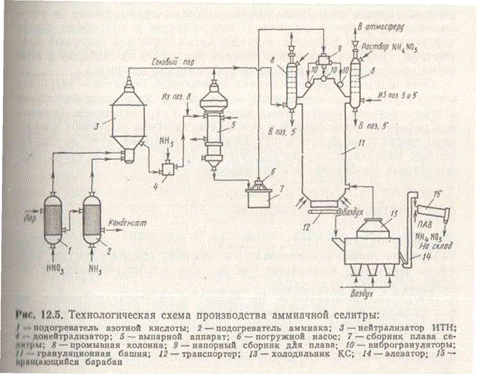
Схема производства аммиачной селитры характеризуется отсутствием жидкостных выбросов. Газовые же потоки оказываются открытыми. Так, в грануляционной башне образуется газопылевая смесь, для очистки которой от пыли селитры используют тарельчатые скрубберы, орошаемые слабым раствором NH4NO3. Сюда же для очистки поступает соковый пар из реактора-нейтрализатора и выпарного аппарата. Схема снабжена автоматическим регулированием расхода реагентов, температуры и рН среды после нейтрализации и выпарки, а также автоматической системой блокировки, прекращающей поступление растворов на выпарку и плава на грануляцию при нарушении параметров режима.
Отмеченные выше недостатки аммиачной селитры — гигроскопичность, слеживаемость и др.— устраняют изготовлением на ее основе сложных и смешанных удобрений. Так, смешением аммиачной селитры с известняком и сульфатом аммония получают известково-аммиачную селитру, сульфонитрат аммония и т. п. Сплавлением NH4NO3 с солями фосфора и калия получают такое ценное полное удобрение, как нитрофоска.
ПРОИЗВОДСТВО КАРБАМИДА
Карбамид (мочевина) (NH2)2CO — наиболее ценное азотное удобрение, легко усваиваемое растениями, содержащее до 46% азота. Карбамид применяют так же, как азотистую добавку, непосредственно в корм скоту.
Карбамид используется не только в сельском хозяйстве, но и в промышленности. Из него готовят карбамидные смолы, идущие на приготовление ценных пластмасс, древесностружечных плит, синтетических клеев, составов для пропитки тканей. Карбамид применяется в фармацевтической промышленности, при очистке нефтепродуктов, для приготовления синтетического волокна и т. п.
Сырьем для производства карбамида служат аммиак и диоксид углерода. Синтез карбамида протекает в две стадии. В первой стадии происходит образование карбаминовокислого аммония (карбамата):
2NH3 + CO2 D NH2COONH4, ΔН = – 159 кДж (а)
Далее карбамат дегидратируется с образованием карбамида:
NH2COONH4 D (NH2)2CO + Н2О, ΔН= –285 кДж (б)
Время дегидратации карбамата резко уменьшается с повышением температуры, при этом возрастает и выход карбамида (рис. 5). Для увеличения выхода карбамида наряду с повышенной температурой используют избыток NH3 сверх стехиометрического, который препятствует образованию побочных продуктов (рис. 6).
Поскольку синтез карбамида протекает с уменьшением газового объема, увеличение давления повышает выход карбамида.
| |
| |
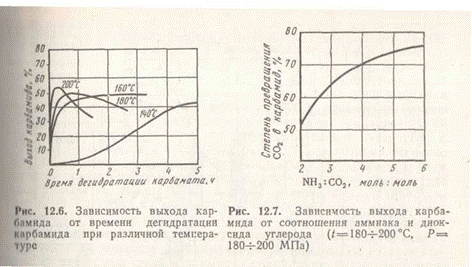
Поскольку синтез карбамида протекает с уменьшением газового объема, увеличение давления повышает выход карбамида. В промышленности синтез карбамида ведут при 180—200°С, 18—20 МПа и 100%-ном избытке аммиака. При использовании 100%-ного диоксида углерода и абсолютно чистого аммиака выход карбамида (по СО2) в оптимальных условиях составляет 60—70%.
Технологические схемы производства карбамида отличаются разными методами разделения и регенерации отходящих газов. Наиболее экономичной является схема с жидкостным рециклом, в упрощенном виде изображенная на рис. 7.
КАЛИЙНЫЕ УДОБРЕНИЯ
В качестве калийных удобрений применяют сырые природные вещества (чаще всего сильвинит) и продукты их переработки (хлорид и сульфат калия), а также золу растений.
Основным сырьем для получения калийных удобрений в СССР является с и л ь в и н и т, представляющий собой породу состава mKCl+nNaCl, которая содержит ~14—18% К2О. В качестве примесей сильвиниту сопутствуют в небольших количествах соединения магния, кальция и др. Из сильвинита получают и основное калийное удобрение — хлорид калия. Получение хлорида калия из сильвинита осуществляется методами галургии, флотационным или комбинированным.
Метод галургии основан на использовании различной растворимости хлоридов калия и натрия. С повышением температуры растворимость КС1 резко возрастает, a NaCl меняется незначительно. При совместном присутствии обеих солей растворимость хлорида натрия с ростом температуры падает, а КС1 — сильно возрастает. На этих различиях и построены галургические операции разделения. При получении хлорида калия сильвинит при повышенной температуре обрабатывают насыщенным на холоду раствором обеих солей. При этом раствор обогащается КС1, а часть NaCl переходит в осадок и отделяется фильтрованием. Затем раствор охлаждают; при этом из него выделяются кристаллы КС1, которые отделяют от маточного раствора и высушивают. Маточный раствор снова направляют на растворение сильвинита. Получаемый таким способом технический продукт содержит 52—60% К2О.
Метод флотации основан на использовании различной смачиваемости водой минералов сильвина (КС1) и галита (NaCl). Флотацию с применением в качестве флотореагентов октадециламина, карбоновых кислот ведут из насыщенных растворов сырых калийных солей. Хлорид калия, получаемый флотационным разделением сильвинита, имеет гораздо более крупную кристаллическую структуру, чем полученный кристаллизацией, поэтому он меньше слеживается.
Дата добавления: 2016-09-26; просмотров: 2254;










