Реальные газы, жидкости, твердые тела
Реальный газ – газ, свойства которого (в отличие от идеального газа) зависят от взаимодействия молекул.
Свойства этих газов резко отличаются при высоких давлениях и низких температурах, когда начинают проявляться квантовые эффекты.
3.1. Силы и потенциальная энергия межмолекулярного взаимодействия
Модель идеального газа, используемая в молекулярно-кинетической теории газов, позволяет описывать поведение разреженных реальных газов при достаточно высоких температурах и низких давлениях. При выводе уравнения состояния идеального газа размерами молекул и их взаимодействием друг с другом пренебрегают. Повышение давления приводит к уменьшению среднего расстояния между молекулами, поэтому необходимо учитывать объем молекул и взаимодействие между ними. Taк, в 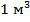 газа при нормальных условиях содержится
газа при нормальных условиях содержится 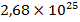 молекул, занимающих объем примерно
молекул, занимающих объем примерно 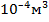 (радиус молекулы, примерно,
(радиус молекулы, примерно, 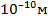 ), которым по сравнению с объемом газа
), которым по сравнению с объемом газа 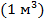 можно пренебречь. При давлении
можно пренебречь. При давлении 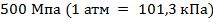 объем молекул составит уже половину всего объема газа. Таким образом, при высоких давлениях и низких температурах указанная модель идеального газа непригодна.
объем молекул составит уже половину всего объема газа. Таким образом, при высоких давлениях и низких температурах указанная модель идеального газа непригодна.
При рассмотренииреальных газов– газов, свойства которых зависят от взаимодействия молекул, надо учитыватьсилы межмолекулярного взаимодействия. Они проявляются на расстояниях 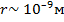 и быстро убывают при увеличении расстояния между молекулами. Такие силы называютсякороткодействующими.
и быстро убывают при увеличении расстояния между молекулами. Такие силы называютсякороткодействующими.
Межмолекулярные взаимодействия– взаимодействия молекул между собой, не приводящие к разрыву или образованию новых химических связей. Межмолекулярные взаимодействия определяют отличие реальных газов от идеальных, существование жидкостей и молекулярных кристаллов. От межмолекулярных взаимодействий зависят многие структурные, спектральные, термодинамические, теплофизические и другие свойства веществ.
Основу межмолекулярных взаимодействий составляют кулоновские силы взаимодействия между электронами и ядрами одной молекулы и ядрами и электронами другой.
|
|
| Рис. 134. |
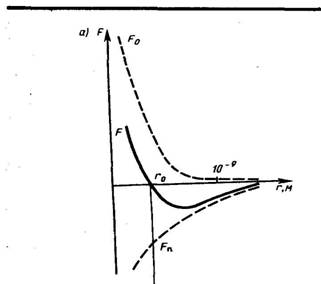
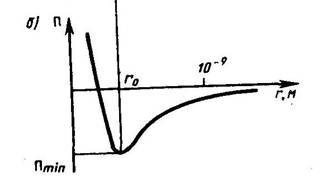
По мере развития представлений о строении атома и квантовой механики, было выяснено, что между молекулами вещества одновременно действуютсилы притяжения и силы отталкивания. На рис. 134 a приведена качественная зависимость сил межмолекулярного взаимодействия от расстояния
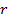 между молекулами, где
между молекулами, где 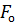 и
и 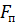 – соответственно силы отталкивания и притяжения, a
– соответственно силы отталкивания и притяжения, a 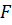 –их результирующая. Силы отталкивания считаются положительными, а силы взаимного притяжения –отрицательными.
–их результирующая. Силы отталкивания считаются положительными, а силы взаимного притяжения –отрицательными.
На расстоянии 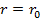 результирующая сила
результирующая сила 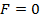 ,т.е. силы притяжения и отталкивания уравновешивают друг друга. Таким образом, расстояние
,т.е. силы притяжения и отталкивания уравновешивают друг друга. Таким образом, расстояние 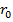 соответствует равновесному расстоянию между молекулами, на котором бы они находились в отсутствие теплового движения. При
соответствует равновесному расстоянию между молекулами, на котором бы они находились в отсутствие теплового движения. При 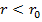 преобладают силы отталкивания
преобладают силы отталкивания 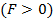 , при
, при 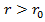 – силы притяжения
– силы притяжения 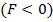 . На расстояниях
. На расстояниях 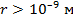 межмолекулярные силы взаимодействия практически отсутствуют
межмолекулярные силы взаимодействия практически отсутствуют 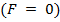 .
.
Элементарная работа 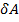 силы
силы 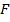 при увеличении расстояния между молекулами на
при увеличении расстояния между молекулами на 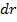 совершается за счет уменьшения взаимной потенциальной энергии молекул, т. е.
совершается за счет уменьшения взаимной потенциальной энергии молекул, т. е.
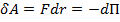 , (1)
, (1)
где 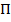 –потенциальная энергия межмолекулярного взаимодействия.
–потенциальная энергия межмолекулярного взаимодействия.
Из анализа качественной зависимости потенциальной энергии взаимодействия молекул от расстояния между ними (рис. 134, б) следует, что если молекулы находятся друг от друга на расстоянии, на котором межмолекулярные силы взаимодействия не действуют 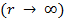 , то
, то 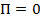 . При постепенном сближении молекул между, ними появляются силы притяжения
. При постепенном сближении молекул между, ними появляются силы притяжения 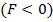 , которые совершают положительную работу
, которые совершают положительную работу 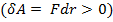 .Тогда, согласно (1), потенциальная энергия взаимодействия уменьшается, достигая минимума при
.Тогда, согласно (1), потенциальная энергия взаимодействия уменьшается, достигая минимума при 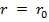 . При
. При 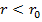 с уменьшением
с уменьшением 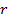 силы отталкивания
силы отталкивания 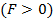 резко возрастают и совершаемая против них работа отрицательна
резко возрастают и совершаемая против них работа отрицательна 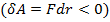 . Потенциальная энергия начинает тоже резко возрастать и становится положительной. Из данной потенциальной кривой следует, что система из двух взаимодействующих молекул в состоянии устойчивого равновесия
. Потенциальная энергия начинает тоже резко возрастать и становится положительной. Из данной потенциальной кривой следует, что система из двух взаимодействующих молекул в состоянии устойчивого равновесия 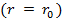 обладает минимальной потенциальной энергией.
обладает минимальной потенциальной энергией.
Критерием различных агрегатных состояний вещества является соотношение между величинами 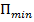 и
и 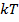 .
. 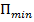 – наименьшая потенциальная энергия взаимодействия молекул – определяет работу, которую нужно совершить против сил притяжения для того, чтобы разъединить молекулы, находящиеся в равновесии
– наименьшая потенциальная энергия взаимодействия молекул – определяет работу, которую нужно совершить против сил притяжения для того, чтобы разъединить молекулы, находящиеся в равновесии 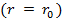 ;
; 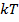 определяет удвоенную среднюю энергию, приходящуюся на одну степень свободы хаотического (теплового) движения молекул. Возможны следующие случаи:
определяет удвоенную среднюю энергию, приходящуюся на одну степень свободы хаотического (теплового) движения молекул. Возможны следующие случаи:
- 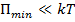 – вещество находиться в газообразном состоянии, так как интенсивное тепловое движение молекул препятствует соединению молекул;
– вещество находиться в газообразном состоянии, так как интенсивное тепловое движение молекул препятствует соединению молекул;
- 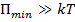 – вещество находится в твёрдом состоянии, так как молекулы, притягиваясь друг к другу, не могут удалиться на значительные расстояния и колеблются около положений равновесия, определяемого расстоянием
– вещество находится в твёрдом состоянии, так как молекулы, притягиваясь друг к другу, не могут удалиться на значительные расстояния и колеблются около положений равновесия, определяемого расстоянием 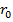 ;
;
- 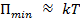 – вещество находится в жидком состоянии, так как в результате теплового движения молекулы перемещаются в пространстве, обмениваясь местами, но не расходясь на расстояние, превышающее
– вещество находится в жидком состоянии, так как в результате теплового движения молекулы перемещаются в пространстве, обмениваясь местами, но не расходясь на расстояние, превышающее 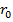 .
.
Таким образом, любое вещество в зависимости от температуры может находиться в газообразном, жидком или твердом агрегатном состоянии, причем температура перехода из одного агрегатного состояния в другое зависит от значения 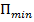 , для данного вещества. Например, у инертных газов
, для данного вещества. Например, у инертных газов 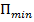 мало, а у металлов велико, поэтому при обычных (комнатных) температурах они находятся соответственно в газообразном и твердом состояниях.
мало, а у металлов велико, поэтому при обычных (комнатных) температурах они находятся соответственно в газообразном и твердом состояниях.
3.2. Уравнение Ван – дер – Ваальса[50]
Для реальных газов необходимо учитывать размеры молекул и их взаимодействие друг с другом, поэтому модель идеального газа и уравнение Клапейрона – Менделеева (для моля газа) 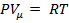 ,описывающее идеальный газ, для реальных газов непригодно.
,описывающее идеальный газ, для реальных газов непригодно.
Учитывая собственный объем молекул и силы межмолекулярного взаимодействия, голландский физик И. Ван – дер – Ваальс(1837–1923) вывел уравнение состояния реального газа. Ван-дер-Ваальсом в уравнение Клапейрона– Менделеева введены две поправки.
1). Учет собственного объема молекул. Наличие сил отталкивания, которые противодействуют проникновению в занятый молекулой объем других молекул, сводится к тому, что фактический свободный объем, в котором могут двигаться молекулы реального газа, будет не 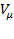 , а
, а 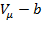 , где
, где  – объем, занимаемый самими молекулами,
– объем, занимаемый самими молекулами, 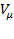 – молярный объём.
– молярный объём.
Объем  равенучетверенному собственному объему молекул. Если, например, в сосуде находятся две молекулы, то центр любой из них не может приблизиться к центру другой молекулы на расстояние, меньшее диаметра
равенучетверенному собственному объему молекул. Если, например, в сосуде находятся две молекулы, то центр любой из них не может приблизиться к центру другой молекулы на расстояние, меньшее диаметра  молекулы. Это означает, что для центров обеих молекул оказывается недоступным сферический объем радиуса
молекулы. Это означает, что для центров обеих молекул оказывается недоступным сферический объем радиуса  , т. е. объем, равный восьми объемам молекулы или учетверенному объему молекулы в расчете на одну молекулу.
, т. е. объем, равный восьми объемам молекулы или учетверенному объему молекулы в расчете на одну молекулу.
2). Учет притяжения молекул. Действие сил притяжения газа приводит к появлению дополнительного давления 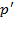 на газ, называемого внутренним давлением. Так как сила, действующая на каждую молекулу со стороны остальных, пропорциональна числу окружающих молекул, т.е. плотности газа, то и
на газ, называемого внутренним давлением. Так как сила, действующая на каждую молекулу со стороны остальных, пропорциональна числу окружающих молекул, т.е. плотности газа, то и 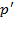 будет пропорциональна квадрату плотности газа или обратно пропорциональна квадрату объёма:
будет пропорциональна квадрату плотности газа или обратно пропорциональна квадрату объёма: 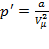 ,где
,где  – постоянная Ван-дер-Ваальса, характеризующая силы межмолекулярного притяжения,
– постоянная Ван-дер-Ваальса, характеризующая силы межмолекулярного притяжения, 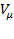 – молярный объем.
– молярный объем.
Вводя эти поправки, получимуравнение Ван-дер-Ваальсадля моля газа(уравнение состояния реальных газов): 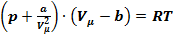 .
.
Для произвольного количества вещества  газа
газа 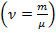 сучетом того, что
сучетом того, что 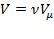 уравнение Ван-дер-Ваальса примет вид:
уравнение Ван-дер-Ваальса примет вид: 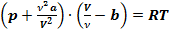 или:
или:
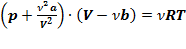 ,
,
где поправки  и
и 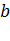 – постоянные для каждого газа величины, определяемые опытным путем.
– постоянные для каждого газа величины, определяемые опытным путем.
В СИ: 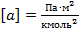 ;
; 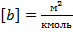 .
.
Для нахождения критических параметров подставим их значения в уравнение Ван – дер – Ваальса и запишем:
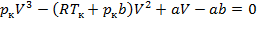 . (1)
. (1)
Поскольку в критической точке все три корня совпадают и равны 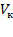 ,, уравнение приводится к виду:
,, уравнение приводится к виду:
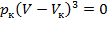 , (2)
, (2)
или 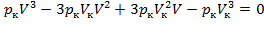 .
.
Taк как уравнения (1) и (2) тождественны, то в них должны быть равны и коэффициенты при неизвестных соответствующих степеней. Поэтому можно записать:
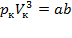 ;
; 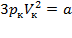 ;
; 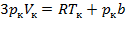 . (3)
. (3)
Решая полученные уравнения, найдем: 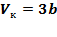 ;
; 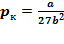 ;
; 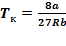 .
.
Уравнение Ван – дер – Вальса – уравнение третьей степени относительно 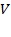 , следовательно, имеет три корня (два из которых могут быть комплексными), т.е. при постоянной температуре и определённом давлении у моля газа могут быть три различных объёма.
, следовательно, имеет три корня (два из которых могут быть комплексными), т.е. при постоянной температуре и определённом давлении у моля газа могут быть три различных объёма.
Реальные газы описываются уравнением Ван – дер – Ваальса лишь приближённо. В целом уравнение Ван – дер – Ваальса даёт лишь качественную картину реального газа.Существуют и другие уравнения, некоторые из них даже точнее описывают реальные газы, но не рассматриваются из-за их сложности.
3.3. Внутренняя энергия реального газа
Внутренняя энергия реального газа будем определяться суммой кинетической энергии 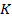 теплового движения его молекул и потенциальной энергии взаимодействия молекул между собой –
теплового движения его молекул и потенциальной энергии взаимодействия молекул между собой – 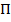 :
: 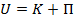 .
.
Кинетическая энергия поступательного и вращательного движений молекул определяет внутреннюю энергию идеального газа: 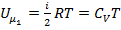 ,где
,где 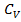 – молярная теплоёмкость газа при постоянном объёме.
– молярная теплоёмкость газа при постоянном объёме.
Работа 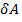 сил молекулярного сцепления, которые вызывают внутреннее давление
сил молекулярного сцепления, которые вызывают внутреннее давление 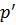 и изменение объёма
и изменение объёма 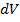 :
: 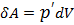 .
.
Так как 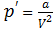 ,то изменение потенциальной энергии, которое произошло за счёт совершения работы
,то изменение потенциальной энергии, которое произошло за счёт совершения работы 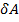 , равно:
, равно: 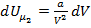 .
.
Интегрируя это выражение, получим: 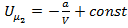 .
.
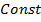 находится из условия, что расстояние между молекулами при безграничном увеличении объёма возрастают и потенциальную энергию при этом следует считать равной нулю:
находится из условия, что расстояние между молекулами при безграничном увеличении объёма возрастают и потенциальную энергию при этом следует считать равной нулю: 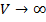 , то
, то 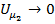 и
и 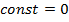 .
.
Для конечного объёма 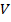 потенциальная энергия моля газа равна:
потенциальная энергия моля газа равна: 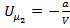 .
.
Внутренняя энергия моля реального газа равна: 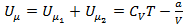 .
.
Таким образом, внутренняя энергия реального газа зависит от температуры 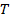 и объёма
и объёма 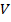 :
:
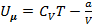 (1)
(1)
Последнее уравнение справедливо для моля реального газа.
Из формулы для внутренней энергии реального газа следует, что его внутренняя энергия растет как с увеличением температуры, так и с увеличением объема. Если реальный газ будет расширяться или сжиматься адиабатически и без совершения внешней работы, то для него, согласно первому началу термодинамики: 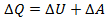 ;
;
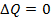 ,
, 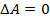 ,
,
следовательно, 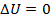 , а значит
, а значит 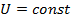 и внутренняя энергия должна оставаться постоянной. Поэтому, из формулы (1) для реального газа, совершающего адиабатический переход без совершения работы, можно записать:
и внутренняя энергия должна оставаться постоянной. Поэтому, из формулы (1) для реального газа, совершающего адиабатический переход без совершения работы, можно записать: 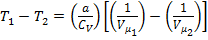 .
.
Из этого уравнения следует, что изменение объема и изменение температуры имеют разные знаки. Следовательно, при адиабатическом расширении в вакуум, реальный газ должен охлаждаться, а при сжатии – нагреваться.
Отметим, что для идеального газа этот эффект не наблюдается:
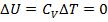 ,
,
следовательно, 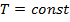 .
.
Рассмотрим расширение реального газа в пустоту. В этом случае внешнее давление равно нулю, поэтому газ не совершает работу против внешних сил. Но в реальном газе действуют силы межмолекулярного взаимодействия, и при расширении газа совершается работа по преодолению этих сил за счет внутренней энергии газа. Вследствие этого температура реального газа при расширении в пустоту должна понижаться.
Однако это не совсем так. В некоторых случаях может происходить и повышение температуры. Реальный газ при расширении охлаждается в том случае, когда преобладает действие сил притяжения между молекулами газа. Тогда молекулы газа совершают работу против сил притяжения за счет своей кинетической энергии, вследствие чего кинетическая энергия уменьшается, т.е. температура понижается. Если преобладает действие сил отталкивания между молекулами газа, то при расширении скорость молекул не уменьшается, а увеличивается, т.е. температура возрастает.
Следовательно, в зависимости от того, что преобладает – силы притяжения между молекулами или силы отталкивания, – может получиться при расширении газа в пустоту или нагревание газа, или охлаждение.
Изменение внутренней энергии реального газа при расширении положено в основу принципа действия машины для сжижения газов.
3.4. Изотермы Ван – дер – Ваальса
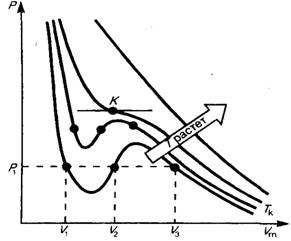 Рис. 135.
Рис. 135.
|
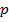 от
от 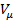 при заданных
при заданных 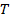 , определяемые уравнением Ван–дер–Ваальса для моля газа. Эти кривые (рассматриваются для четырех различных температур; рис. 135) имеют довольно своеобразный характер. При высоких температурах
, определяемые уравнением Ван–дер–Ваальса для моля газа. Эти кривые (рассматриваются для четырех различных температур; рис. 135) имеют довольно своеобразный характер. При высоких температурах 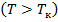 изотерма реального газа отличается от изотермы идеального газа только некоторым искажением ее формы, оставаясь монотонно спадающей кривой. При некоторой температуре
изотерма реального газа отличается от изотермы идеального газа только некоторым искажением ее формы, оставаясь монотонно спадающей кривой. При некоторой температуре 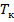 на изотерме имеется лишь одна точка перегиба
на изотерме имеется лишь одна точка перегиба 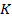 .
.
Эта изотерма называется критической, соответствующая ей температура 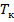 –критической температурой; точка перегиба
–критической температурой; точка перегиба 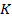 называется критической точкой; в этой точке касательная к ней параллельна оси абсцисс. Соответствующие этой точке объем
называется критической точкой; в этой точке касательная к ней параллельна оси абсцисс. Соответствующие этой точке объем 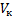 , и давление
, и давление 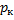 называются также критическими. Состояние с критическими параметрами
называются также критическими. Состояние с критическими параметрами 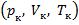 называется критическим состоянием. При низких температурах
называется критическим состоянием. При низких температурах 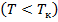 изотермы имеют волнообразный участок, сначала монотонно опускаясь вниз, затем монотонно поднимаясь вверх и снова монотонно опускаясь.
изотермы имеют волнообразный участок, сначала монотонно опускаясь вниз, затем монотонно поднимаясь вверх и снова монотонно опускаясь.
При 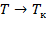 стирается различие между жидким и газообразным состоянием вещества, различие в плотности жидкости и пара, обращаются в нуль удельная теплота парообразования и коэффициент поверхностного натяжения (рис. 136).
стирается различие между жидким и газообразным состоянием вещества, различие в плотности жидкости и пара, обращаются в нуль удельная теплота парообразования и коэффициент поверхностного натяжения (рис. 136).
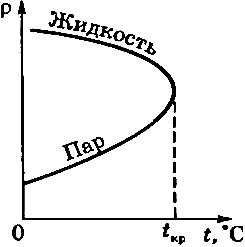 Рис. 136.
Рис. 136.
|
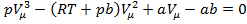 .
.
Уравнение Ван – дер – Ваальса при заданных 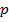 и Т является уравнением третьей степени относительно
и Т является уравнением третьей степени относительно 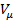 ; следовательно, оно может иметь либо три вещественных корня, либо один вещественный и два мнимых, причем физический смысл имеют лишь вещественные положительные корни. Поэтому первому случаю соответствуют изотермы при низких температурах (три значения объема газа
; следовательно, оно может иметь либо три вещественных корня, либо один вещественный и два мнимых, причем физический смысл имеют лишь вещественные положительные корни. Поэтому первому случаю соответствуют изотермы при низких температурах (три значения объема газа 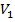 ,
, 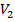 и
и 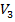 отвечают (символ «
отвечают (символ « 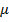 » для простоты опускаем) одному значению давления
» для простоты опускаем) одному значению давления 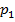 P1, второму случаю – изотермы при высоких температурах.
P1, второму случаю – изотермы при высоких температурах.
 Рис. 137.
Рис. 137.
|
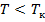 (рис. 137), видим, что на участках 1–3 и 5–7 при уменьшении объема
(рис. 137), видим, что на участках 1–3 и 5–7 при уменьшении объема 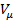 давление
давление 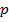 возрастает, что естественно. На участке 3–5 сжатие вещества приводит к уменьшению давления; практика же показывает, что такие состояния в природе не осуществляются. Наличие участка 3–5 означает, что при постепенном изменении объема вещество не может оставаться все время в виде однородной среды; в некоторый момент должно наступить скачкообразное изменение состояния и распад вещества на две фазы. Таким образом, истинная изотерма будет иметь вид ломаной линии 7–6–2–1. Часть 6–7 отвечает газообразному состоянию, а часть 2–1– жидкому. В состояниях, соответствующих горизонтальному участку изотермы 6–2, наблюдается равновесие жидкой и газообразной фаз вещества. Вещество в газообразном состоянии при температуре ниже критической называется паром, а пар, находящийся в равновесии со своей жидкостью, называется насыщенным.
возрастает, что естественно. На участке 3–5 сжатие вещества приводит к уменьшению давления; практика же показывает, что такие состояния в природе не осуществляются. Наличие участка 3–5 означает, что при постепенном изменении объема вещество не может оставаться все время в виде однородной среды; в некоторый момент должно наступить скачкообразное изменение состояния и распад вещества на две фазы. Таким образом, истинная изотерма будет иметь вид ломаной линии 7–6–2–1. Часть 6–7 отвечает газообразному состоянию, а часть 2–1– жидкому. В состояниях, соответствующих горизонтальному участку изотермы 6–2, наблюдается равновесие жидкой и газообразной фаз вещества. Вещество в газообразном состоянии при температуре ниже критической называется паром, а пар, находящийся в равновесии со своей жидкостью, называется насыщенным.
 Рис. 138.
Рис. 138.
|
 ,
, 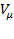 под изотермой на три области: под колоколообразной кривой располагается область двухфазных состояний (жидкость и насыщенный пар), слева от нее находится область жидкого состояния, а справа – область пара. Пар отличается от остальных газообразных состояний тем, что при изотермическом сжатии претерпевает процесс сжижения. Газ же при температуре выше критической не может быть превращен в жидкость ни при каком давлении.
под изотермой на три области: под колоколообразной кривой располагается область двухфазных состояний (жидкость и насыщенный пар), слева от нее находится область жидкого состояния, а справа – область пара. Пар отличается от остальных газообразных состояний тем, что при изотермическом сжатии претерпевает процесс сжижения. Газ же при температуре выше критической не может быть превращен в жидкость ни при каком давлении.
Сравнивая изотерму Ван–дер–Ваальса с изотермой Эндрюса (верхняя кривая на рис. 138), видим, что последняя имеет прямолинейный участок 2–6, соответствующий двухфазным состояниям вещества. Правда, при некоторых условиях могут быть реализованы состояния, изображаемые участками ван -дер-ваальсовой изотермы 5–6 и 2–3. Эти неустойчивые состояния называются метастабильными[51]. Участок 2–3 изображает перегретую жидкость, 5–6 –пересыщенный пар. Обе фазы ограниченно устойчивы.
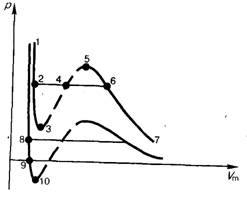 Рис. 139.
Рис. 139.
|
При достаточно низких температурах изотерма пересекает ось
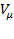 , переходя в область отрицательных давлений (нижняя кривая на рис. 139). Вещество под отрицательным давлением находится в состоянии растяжения. При некоторых условиях такие состояния также реализуются. Участок 8–9 на нижней изотерме соответствует перегретой жидкости, участок 9–10 –растянутой жидкости.
, переходя в область отрицательных давлений (нижняя кривая на рис. 139). Вещество под отрицательным давлением находится в состоянии растяжения. При некоторых условиях такие состояния также реализуются. Участок 8–9 на нижней изотерме соответствует перегретой жидкости, участок 9–10 –растянутой жидкости.
3.5. Эффект Джоуля – Томсона
Наличие потенциальной энергии взаимодействия молекул проявляется в эффекте Джоуля – Томсона: изменение температуры реального газа при изменении его объёма без теплообмена и без совершения внешней работы.
Если температура 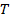 газа понижается
газа понижается 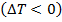 , то эффект считается положительным; если газ нагревается
, то эффект считается положительным; если газ нагревается 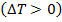 , то эффект считается отрицательным. Если при расширении не нагревается и не охлаждается, то эффект Джоуля – Томсона равен нулю. Такое состояние отображается точкой инверсии. Точка инверсии определяет температуру, вблизи которой эффект меняет свой знак.
, то эффект считается отрицательным. Если при расширении не нагревается и не охлаждается, то эффект Джоуля – Томсона равен нулю. Такое состояние отображается точкой инверсии. Точка инверсии определяет температуру, вблизи которой эффект меняет свой знак.
Положительный эффект Джоуля – Томсона используется при получении низких температур.
Глубокого охлаждения газов достигают двумя путями:
1). Температура газа понижается при его расширении вследствие совершения работы против сил сцепления молекул;
2). Температура газа понижается при адиабатном расширении вследствие совершения работы против внешних сил.
Применение первого способа возможно при охлаждении газа ниже температуры инверсии и ниже критической температуры. В настоящее время подвергнуты сжижению и отвердеванию все газы, включая гелий, критическая температура которого 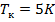 .
.
3.6. Свойства жидкостей. Поверхностное натяжение
Жи́дкость – вещество, находящееся в жидком агрегатном состоянии, занимающем промежуточное положение между твёрдым и газообразным состояниями. Основным свойством жидкости, отличающим её от веществ, находящихся в других агрегатных состояниях, является способность неограниченно менять форму под действием касательных механических напряжений, даже сколь угодно малых, практически сохраняя при этом объём.
Общая информация о жидком состоянии
Жидкое состояние обычно считают промежуточным между твёрдым телом и газом: газ не сохраняет ни объём, ни форму, а твёрдое тело сохраняет и то, и другое.
Форма жидких тел может полностью или отчасти определяться тем, что их поверхность ведёт себя как упругая мембрана. Так, вода может собираться в капли. Но жидкость способна течь даже под своей неподвижной поверхностью, и это тоже означает несохранение формы (внутренних частей жидкого тела).
Молекулы жидкости не имеют определённого положения, но в то же время им недоступна полная свобода перемещений. Между ними существует притяжение, достаточно сильное, чтобы удержать их на близком расстоянии.
Вещество в жидком состоянии существует в определённом интервале температур, ниже которого переходит в твердое состояние (происходит кристаллизация либо превращение в твердотельное аморфное состояние–стекло), выше– в газообразное (происходит испарение). Границы этого интервала зависят от давления.
Как правило, вещество в жидком состоянии имеет только одну модификацию. (Наиболее важные исключения– это квантовые жидкости и жидкие кристаллы.) Поэтому в большинстве случаев жидкость является не только агрегатным состоянием, но и термодинамической фазой (жидкая фаза).
Все жидкости принято делить на чистые жидкости и смеси. Некоторые смеси жидкостей имеют большое значение для жизни: кровь, морская вода и др. Жидкости могут выполнять функцию растворителей.
Физические свойства жидкостей
1).Текучесть
Основным свойством жидкостей является текучесть. Если к участку жидкости, находящейся в равновесии, приложить внешнюю силу, то возникает поток частиц жидкости в том направлении, в котором эта сила приложена: жидкость течёт. Таким образом, под действием неуравновешенных внешних сил жидкость не сохраняет форму и относительное расположение частей, и поэтому принимает форму сосуда, в котором находится.
В отличие от пластичных твёрдых тел, жидкость не имеет предела текучести: достаточно приложить сколь угодно малую внешнюю силу, чтобы жидкость потекла.
2).Сохранение объёма
Одним из характерных свойств жидкости является то, что она имеет определённый объём (при неизменных внешних условиях). Жидкость чрезвычайно трудно сжать механически, поскольку, в отличие от газа, между молекулами очень мало свободного пространства. Давление, производимое на жидкость, заключенную в сосуд, передаётся без изменения в каждую точку объёма этой жидкости (закон Паскаля, справедлив также и для газов). Эта особенность, наряду с очень малой сжимаемостью, используется в гидравлических машинах.
Жидкости обычно увеличивают объём (расширяются) при нагревании и уменьшают объём (сжимаются) при охлаждении. Впрочем, встречаются и исключения, например, вода сжимается при нагревании, при нормальном давлении и температуре от 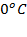 до приблизительно
до приблизительно 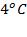 .
.
3).Вязкость
Кроме того, жидкости (как и газы) характеризуются вязкостью. Она определяется как способность оказывать сопротивление перемещению одной из частей относительно другой– то есть как внутреннее трение.
Когда соседние слои жидкости движутся относительно друг друга, неизбежно происходит столкновение молекул дополнительно к тому, которое обусловлено тепловым движением. Возникают силы, затормаживающие упорядоченное движение. При этом кинетическая энергия упорядоченного движения переходит в тепловую– энергию хаотического движения молекул.
Жидкость в сосуде, приведённая в движение и предоставленная самой себе, постепенно остановится, но её температура повысится.
4).Смешиваемость
Смешиваемость– способность жидкостей растворяться друг в друге. Пример смешиваемых жидкостей: вода и этиловый спирт, пример несмешиваемых: вода и жидкое масло.
5).Образование свободной поверхности и поверхностное натяжение
Из-за сохранения объёма жидкость способна образовывать свободную поверхность. Такая поверхность является поверхностью раздела фаз данного вещества: по одну сторону находится жидкая фаза, по другую– газообразная (пар), и, возможно, другие газы, например, воздух.
Если жидкая и газообразная фазы одного и того же вещества соприкасаются, возникают силы, которые стремятся уменьшить площадь поверхности раздела– силы поверхностного натяжения. Поверхность раздела ведёт себя как упругая мембрана, которая стремится стянуться.
6).Волны плотности
Хотя жидкость чрезвычайно трудно сжать, тем не менее, при изменении давления её объем и плотность всё же меняются. Это происходит не мгновенно; так, если сжимается один участок, то на другие участки такое сжатие передаётся с запаздыванием. Это означает, что внутри жидкости способны распространяться упругие волны, более конкретно, волны плотности. Вместе с плотностью меняются и другие физические величины, например, температура.
Если при распространении волны́ плотность меняется достаточно слабо, такая волна называется звуковой волной, или звуком.
Если плотность меняется достаточно сильно, то такая волна называется ударной волной. Ударная волна описывается другими уравнениями.
Волны плотности в жидкости являются продольными, то есть плотность меняется вдоль направления распространения волны. Поперечные упругие волны в жидкости отсутствуют из-за несохранения формы.
Упругие волны в жидкости со временем затухают, их энергия постепенно переходит в тепловую энергию. Причины затухания– вязкость, «классическое поглощение», молекулярная релаксация и другие. При этом работает так называемая вторая, или объёмная вязкость– внутреннее трение при изменении плотности. Ударная волна в результате затухания через какое-то время переходит в звуковую.
Упругие волны в жидкости подвержены также рассеянию на неоднородностях, возникающих в результате хаотического теплового движения молекул.
Строение жидкостей
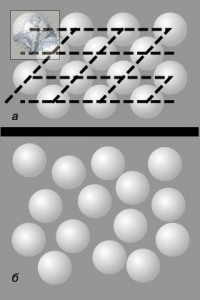 Рис. 140. Дальний и ближний порядок:а – двумерная модель твердого тела, иллюстрирующая наличие дальнего порядка; б – двумерная модель жидкости, иллюстрирующая наличие только ближнего порядка.
Рис. 140. Дальний и ближний порядок:а – двумерная модель твердого тела, иллюстрирующая наличие дальнего порядка; б – двумерная модель жидкости, иллюстрирующая наличие только ближнего порядка.
|
Экспериментальные исследования жидкого состояния вещества, основанные на наблюдении дифракции рентгеновских лучей и потоков нейтронов при прохождении их через жидкие среды, обнаружили наличие в жидкости ближнего порядка[52], т.е. наличие некоторой упорядоченности в расположении частиц лишь на малом расстоянии от какой-либо выделенной позиции (рис. 140).
Взаимное расположение соседних частиц в жидкостях сходно с упорядоченным расположением соседних частиц в кристаллах. Однако, эта упорядоченность в жидкостях наблюдается лишь внутри малых объёмов. При расстояниях: 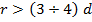 от некоторой выбранной «центральной» молекулы упорядоченность нарушается (
от некоторой выбранной «центральной» молекулы упорядоченность нарушается ( 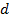 –эффективный диаметр молекулы). Подобная упорядоченность в расположении частиц в жидкостях и называется ближним порядком.
–эффективный диаметр молекулы). Подобная упорядоченность в расположении частиц в жидкостях и называется ближним порядком.
Из – за отсутствия дальнего порядка жидкости, за немногим исключением, не обнаруживают анизотропии, характерной для кристаллов. По этой причине структуру жидкости иногда называют квазикристаллической или кристаллоподобной.
Впервые идея о близости некоторых свойств жидкостей (особенно расплавов металлов) и кристаллических твердых тел была высказана и затем развивалась в работах советского физика Я.И.Френкеля еще 1930–1940-х. Согласно взглядам Френкеля, получившим теперь всеобщее признание, тепловое движение атомов и молекул в жидкости состоит из нерегулярных колебаний со средней частотой, близкой к частоте колебаний атомов в кристаллических телах. Центр колебаний определяется при этом полем сил соседних частиц и смещается вместе со смещениями этих частиц.
Упрощенно можно представить такое тепловое движение как наложение друг на друга сравнительно редких перескоков частиц из одних временных положений равновесия в другие и тепловых колебаний в промежутках между скачками. Среднее время 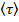 «оседлого» пребывания молекулы жидкости вблизи некотрого положения равновесия называется временем релаксации. По истечеии времени
«оседлого» пребывания молекулы жидкости вблизи некотрого положения равновесия называется временем релаксации. По истечеии времени 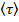 молекула меняет место равновесия, скачком перемещаясь в новое положение, отстоящее от предыдущего на расстояние порядка размеров самих молекул. Таким образом, молекула медленно перемещается внутри жидкости. С ростом температуры время
молекула меняет место равновесия, скачком перемещаясь в новое положение, отстоящее от предыдущего на расстояние порядка размеров самих молекул. Таким образом, молекула медленно перемещается внутри жидкости. С ростом температуры время 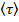 уменьшается, подвиждность молекул возрасчтает, что влечёт за собой уменьшенине вязкости жидкостей (возрастает текучесть). По образному выражению Я.И.Френкеля, молекулы странствуют по всему объему жидкости, ведя кочевой образ жизни, при котором кратковременные переезды сменяются относительно длинными периодами оседлой жизни.
уменьшается, подвиждность молекул возрасчтает, что влечёт за собой уменьшенине вязкости жидкостей (возрастает текучесть). По образному выражению Я.И.Френкеля, молекулы странствуют по всему объему жидкости, ведя кочевой образ жизни, при котором кратковременные переезды сменяются относительно длинными периодами оседлой жизни.
Аморфные твёрдые тела (стекло, смолы, битум и т.д.) можно рассматривать как переохлаждённые жидкости, частицы которых из-за сильно возросшей вязкости имеют ограниченную подвижность.
Из-за малой упорядоченности жидкого состояния теория жидкости оказывается менее развитой, чем теория газов и кристаллических твердых тел. Пока нет полной теории жидкости.
Особый тип жидкостей – это некоторые органические соединения, состоящие из молекул удлиненной или дискообразной формы, или так называемые жидкие кристаллы. Взаимодействие между молекулами в таких жидкостях стремится выстроить длинные оси молекул в определенном порядке. При высоких температурах тепловое движение препятствует этому, и вещество представляет собой обычную жидкость. При температурах ниже критической в жидкости появляется выделенное направление, возникает дальний ориентационный порядок. Сохраняя основные черты жидкости, например, текучесть, жидкие кристаллы обладают характерными свойствами твердых кристаллов – анизотропией магнитных, электрических и оптических свойств. Эти их свойства (наряду с текучестью) находят многочисленные технические применения, например, в электронных часах, калькуляторах, мобильных телефонах, а также в мониторах персональных компьютеров, телевизорах, в качестве индикаторов, табло и экранов для отображения цифровой, буквенной и аналоговой информации.
Поверхностное натяжение
Наиболее интересной особенностью жидкостей является наличие свободной поверхности. С поверхностью жидкости связана свободная энергия, пропорциональная площади  свободной поверхности жидкости:
свободной поверхности жидкости: 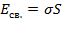 . Так как свободная энергия изолированной системы стремится к минимуму, то жидкость (в отсутствие внешних полей) стремится принять форму, имеющую минимальную площадь поверхности. Таким образом, задача о форме жидкости сводится к изопериметрической задаче при заданных дополнительных условиях (начальное распределение, объём ит.п.). Свободная капля принимает форму шара, однако пр
. Так как свободная энергия изолированной системы стремится к минимуму, то жидкость (в отсутствие внешних полей) стремится принять форму, имеющую минимальную площадь поверхности. Таким образом, задача о форме жидкости сводится к изопериметрической задаче при заданных дополнительных условиях (начальное распределение, объём ит.п.). Свободная капля принимает форму шара, однако пр
Дата добавления: 2016-09-26; просмотров: 8708;











