Структура ферментов
Ферменты – это высокоспециализированные белки, способные повышать скорость реакции в живых организмах. Ферменты - биологические катализаторы.
Все ферменты являются белками, как правило, глобулярными. Они могут относиться как к простым, так и к сложным белкам. Белковая часть фермента может состоять из одной полипептидной цепи и относиться к мономерным белкам (например, пепсин). Ряд ферментов являются олигомерными белками, включают в свой состав несколько протомеров или субъединиц. Протомеры, объединяясь в олигомерную структуру, соединяются самопроизвольно непрочными нековалентными связями. В процессе объединения (кооперации) происходят структурные изменения отдельных протомеров, в результате чего активность фермента заметно возрастает. Отделение (диссоциация) протомеров и их объединение в олигомерный белок является механизмом регуляции активности ферментов.
Субъединицы (протомеры) в олигомерах могут быть или одинаковыми, или отличающимися по первичной - третичной структуре (конформации). В случае соединения различных протомеров в олигомерную структуру фермента возникают множественные формы одного и того же фермента – изоферменты.
Изоферменты катализируют одну и ту же реакцию, но отличаются по набору субъединиц, физико-химическим свойствам, электрофоретической подвижности, по сродству к субстратам, активаторам, ингибиторам. Например, лактатдегидрогеназа (ЛДГ) – фермент, окисляющий молочную кислоту в пировиноградную кислоту, является тетрамером. Он состоит из четырёх протомеров двух типов. Один вид протомеров обозначается Н (выделен из сердечной мышцы), второй протомер обозначается М (выделен из скелетной мускулатуры). Возможно 5 сочетаний этих протомеров в составе ЛДГ: Н4, Н3М, Н2М2, Н1М3, М4 соответственно ЛДГ1, ЛДГ2,ЛДГ3,ЛДГ4, ЛДГ5.
Биологическая роль изоферментов.
- Изоферменты обеспечивают протекание химических реакций в соответствии с условиями в разных органах. Так, изофермент ЛДГ1 – обладает высоким сродством к кислороду, поэтому он активен в тканях с высокой скоростью окислительных реакций (эритроциты, миокард). Изофермент ЛДГ5 активен в присутствии высокой концентрации лактата, наиболее характерен для ткани печени.
- Выраженная органоспецифичность изоферментов используется для диагностики заболеваний различных органов.
- Изоферменты изменяют свою активность с возрастом. Так, у плода при недостатке кислорода преобладает ЛДГ3, а с увеличением возраста и увеличением поступления кислорода возрастает доля ЛДГ2.
Если фермент является сложным белком, то он состоит из белковой и небелковой части. Белковая часть является высокомолекулярной, термолябильной частью фермента и называется апоферментом. Он имеет своеобразную структуру и определяет специфичность ферментов.
Небелковая часть фермента называется кофактором (коферментом). Кофактором чаще всего являются ионы металлов, которые могут прочно связываться с апоферментом (например, Zn в ферменте карбоангидразе, Сu в ферменте цитохромоксидазе). Коферменты обычно являются органическими веществами, менее прочно связанными с апоферментом. Коферментами являются, в частности, нуклеотиды НАД, ФАД. Кофермент– низкомолекулярная, термостабильная часть фермента. Его роль заключается в том, что он определяет пространственную укладку (конформацию) апофермента, и определяет его активность. Некоторые кофакторы могут переносить электроны, функциональные группы, участвовать в образовании дополнительных связей между ферментом и субстратом.
В функциональном отношении в ферменте принято выделять два важных участка в молекуле фермента: активный центр и аллостерический участок.
Активный центр – это участок молекулы фермента, который взаимодействует с субстратом и участвует в каталитическом процессе. Активный центр фермента образован радикалами аминокислот, удалённых друг от друга в первичной структуре. Активный центр имеет трёхмерную укладку, чаще всего в его составе выявляются реакционноспособные
- ОН группы серина
- SH – цистеина
- NH2 лизина
- γ-СООН глютаминовой кислоты
Схема активного центра фермента
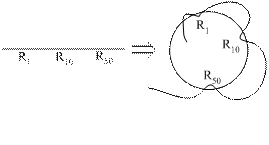
В активном центре различают две зоны – зону связывания с субстратом и каталитическую зону.
Зона связывания обычно имеет жёсткую пространственную структуру, к которой комплементарно присоединяется субстрат реакции. Например, трипсин расщепляет белки в участках, богатых положительно заряженной аминокислотой лизином, так как в его зоне связывания содержатся остатки отрицательно заряженных аспарагиновой и глютаминовой кислот.
Каталитическая зона - это участок активного центра, непосредственно воздействующий на субстрат и осуществляющий каталитическую функцию. Эта зона более подвижна, в ней возможно изменение взаиморасположения функциональных групп.
В ряде ферментов (чаще олигомерных) кроме активного центра присутствует аллостерический участок – участок молекулы фермента, удалённый от активного центра и взаимодействующий не с субстратом, а с дополнительными веществами (регуляторами, эффекторами). В аллостерических ферментах в одной субъединице может находиться активный центр, в другой - аллостерический участок. Аллостерические ферменты изменяют свою активность следующим образом: эффектор (активатор, ингибитор) действует на аллостерическую субъединицу и изменяет её структуру. Затем изменение конформации аллостерической субъединицы по принципу кооперативных изменений опосредованно меняет структуру каталитической субъединицы, что сопровождается изменение активности фермента.
Дата добавления: 2016-09-26; просмотров: 2943;











