Снижение ферментами энергии активации
Например, энергия расщепления Н2О2 без ферментов и катализаторов – 18 000 ккал на моль. Если в качестве катализатора используется платина при высокой температуре, энергия активации снижается до 12 000 ккал/моль. При участии фермента каталазы энергия активации составляет лишь 2 000 ккал/моль.
Уменьшение Еа происходит в результате образования промежуточных фермент-субстратных комплексов по схеме: F+S <=> FS-комплекс → F + продукты реакции. Впервые возможность образования фермент- субстратных комплексов была доказана
Л. Михаэлисом, М. Ментеном. Впоследствии многие фермент-субстратные комплексы были выделены. Для объяснения высокой избирательности ферментов при взаимодействии с субстратом предложена теория «ключа и замка» Э Фишера. Согласно ей, фермент взаимодействует с субстратом только при абсолютном соответствии их друг другу (комплементарность) наподобие ключа и замка. Данная теория объясняла специфичность ферментов, но не раскрывала механизм их воздействия на субстрат. Позже разработана теория индуцированного соответствия фермента и субстрата - теория Д. Кошланда (теория «резиновой перчатки»). Её суть состоит в следующем: активный центр фермента сформирован и содержит все функциональные группы ещё до взаимодействия с субстратом (положение 1 на рисунке). Однако эти функциональные группы находятся в неактивном состоянии. Субстрат при присоединении к ферменту индуцирует изменение положения, структуры радикалов в активном центре фермента. В результате активный центр фермента под действием субстрата переходит в активное состояние и, в свою очередь, начинает воздействовать на субстрат, т.е. происходит взаимодействие активного центра фермента и субстрата (положение 2 на рисунке). Вследствие этого субстрат переходит в нестабильное, неустойчивое состояние, что ведёт к уменьшению энергии активации и образованию продуктов реакции с переходом структуры активного центра в исходное состояние (положение 3 на рисунке).
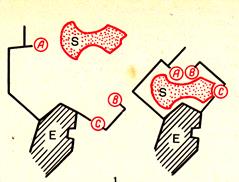
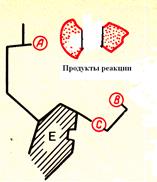
1 2 3
Взаимодействие фермента и субстрата может заключаться в реакциях нуклеофильного замещения, электрофильного замещения, дегидратации субстрата. Возможно также кратковременное ковалентное взаимодействие функциональных групп фермента с субстратом. В основном происходит геометрическая переориентация функциональных групп активного центра.
Дата добавления: 2016-09-26; просмотров: 1946;











