Четвертичная структура белков
Четвертичной структурой обладают белки, состоящие из нескольких полипептидных цепей, ковалентно не связанных друг с другом. Их называют олигомерными белками. Протомером считается отдельная полипептидная цепь, имеющая три уровня структурной организации, субъединицей – функционально активная часть олигомерного белка. Субъединица может содержать один протомер или несколько протомеров. Четвертичная структура - количество и взаимное расположение субъединиц в олигомерных белках.
В формировании четвертичной структуры участвуют непрочные нековалентные связи (гидрофобные, ионные, водородные). Четвертичная структура белков формируются самопроизвольно, и легко нарушается различными воздействиями. Отдельные субъединицы в олигомером белке влияют друг на друга, что приводит к изменению третичной структуры отдельных протомеров. Это явление называется кооперативными изменениями конформации протомеров и сопровождается изменением биологической активности белка.
Олигомерные белки имеют ряд особенностей в сравнении с мономерными белками:
- имеют очень компактную укладку и относительно небольшую поверхность раздела, поэтому, располагаясь внутриклеточно, они связывают меньше воды;
- их потеря клетками менее вероятна;
- они функционально более приспособлены к условиям организма, поскольку их активность в организме регулируется через кооперативность свойств;
- если в синтезе олигомерного белка участвуют однотипные протомеры, это экономит генетический материал (на коротком участке ДНК «штампуется» несколько одинаковых протомеров);
- их потеря клетками менее вероятна;
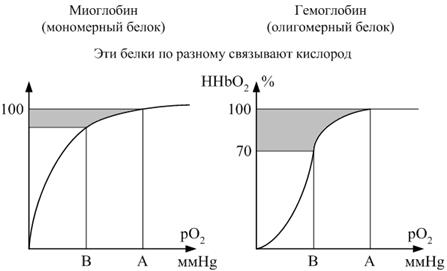
Уникальную функциональность олигомерных белков иллюстрирует сравнение белков гемоглобина и миоглобина, участвующих в переносе кислорода в ткани. Гемоглобин эритроцитов - олигомерный белок, включает 4 полипептидные цепи. Миоглобин мышц – мономерный белок, включает 1 полипептидную цепь. Кривая насыщения кислородом у миоглобина свидетельствует о прямой зависимости её от концентрации кислорода. Для гемоглобина кривая насыщения кислородом носит S-образный характер. Это связано с постепенным последовательным изменением структуры (конформации) каждого из 4-х протомеров в составе гемоглобина, в результате чего резко возрастает сродство гемоглобина к кислороду. Такой характер насыщения гемоглобина кислородом значительно повышает его кислородную ёмкость по сравнению с миоглобином.
Графики насыщения миоглобина и гемоглобина кислородом при перепаде парциального давления кислорода в венозной (В) и артериальной крови (А) представлены
ниже.
Доменные белки
Особое положение среди белков занимают доменные белки.
Домены – структурно и функционально обособленные участки одной полипептидной цепи. Домены могут отвечать за взаимодействие белка с различными веществами - лигандами (низкомолекулярные вещества, ДНК, РНК, полисахариды и др.) Примерами доменных белков служат альбумин сыворотки крови, иммуноглобулины, некоторые ферменты (трипсин поджелудочной железы).

В силу высокой избирательности белков они могут объединяться в комплексы, которые чаще всего называются полиферментными комплексами – структурные объединения нескольких ферментов, катализирующих отдельные стадии сложного химического процесса. Например: пируватдегидрогеназный комплекс (ПДК) включает три вида ферментов, катализирующий окисление пировиноградной кислоты (ПВК).
Возможно специфическое соединение не только отдельных белков, но и белков с липидами (жирами) при образовании клеточных мембран, белков с нуклеиновыми кислотами при формировании хроматина.
Дата добавления: 2016-09-26; просмотров: 3221;











