Третичная структура белков
Третичная структура - специфическая для каждого белка форма укладки полипептидной цепи в пространстве. Данная структура формируется самопроизвольно и определяется первичной структурой. Третичная структура значительно, в десятки раз увеличивает компактность белка. В формировании третичной структуры участвуют нековалентные связи (гидрофобные, ионные) и ковалентные (дисульфидные) связи, изображённые на рисунке.
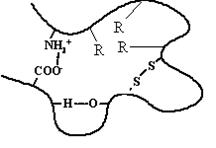
Третичная структура определяет биологическую активность и некоторые физико-химические свойства белков. Изменения в третичной структуре белка отражается на его биологической активности.
Методами изучения третичной структуры являются рентгеноструктурный анализ и определение химической доступности отдельных радикалов аминокислот в белке. Третичная структура белка миоглобина впервые была изучена Дж. Кендрью (1957 г.). М. Перутцем (1959 г.) была изучена структура гемоглобина.
В третичную структуру белков входят α - спиральные, β - складчатые структуры, β- петли (в них полипептидная цепь изгибается на 1800) и, так называемый, неупорядоченный клубок. Например, в белке инсулине содержится 57% α - спиральных участков, 6% β- складчатых структур, 10% молекулы уложены в виде β - петлей и 27% молекулы представляют неупорядоченный клубок.
Совокупность первичной, вторичной, третичной структур составляет конформацию белковой молекулы. Прижизненная (нативная) конформация формируется самопроизвольно, и её образование носит название фолдинг. Конформация белков очень не устойчива и формируется при участии особых белков – шаперонов (компаньонов). Шапероны способны связываться с частично денатурированными, находящимися в неустойчивом состоянии белками, и восстанавливать их нативную конформацию. Шапероны классифицируют по их молекулярной массе (60 – 100 кд.). Наиболее изучены Ш-60, Ш-70 и Ш-90. Например, Ш-70 взаимодействуют с белками, богатыми гидрофобными радикалами, защищают их от высокотемпературной денатурации. В целом шапероны экранируют основные белки организма, препятствуют денатурации и способствуют формировании конформации, облегчают транспорт денатурированных белков в лизосомы, участвуют в процессе синтеза белков.
По конформации все белки делятся на три группы:
- фибриллярные белки: коллаген, эластин, фиброин;
- глобулярные белки: гемоглобин, альбумин, глобулин;
- смешанные белки: миозин.
Третичная структура присуща всем белкам.
Дата добавления: 2016-09-26; просмотров: 3036;











