Первичная структура белков
Первичная структура – порядок чередования аминокислот в полипептидной цепи.
Впервые первичная структура изучена в 1954 году Ф. Сенджером для гормона инсулина. Изучение первичной структуры представляет сложный процесс и включает два основных этапа: изучение аминокислотного состава и изучение последовательности соединения аминокислот в полипептидной цепи.
1. Изучение аминокислотного состава белка осуществляется путём его гидролиза до аминокислот. Для разрыва прочных пептидных связей между аминокислотами используют кислотный, щелочной и ферментативный гидролиз белка. Кислотный гидролиз осуществляется путём кипячения раствора белка с 6-нормальным раствором соляной кислоты в течение 16 - 92 часов. Щелочной гидролиз производится кипячением раствора белка с 2-4 нормальным раствором NaOH в течение 4 – 8 часов. Ферментативный гидролиз происходит при участии ферментов протеиназ (пептидаз): трипсин, пепсин. В отличие от кислотного и щелочного гидролиза ферментативный гидролиз (протеолиз) наиболее специфичен, при нём ферменты расщепляют только определённые связи в белках. Окончание процесса гидролиза оценивают по двум признакам: а) по отсутствию положительной биуретовой реакции на пептидные связи и б) по окончанию прироста концентрации аминогрупп и карбоксильных групп в гидролизате. Динамику прироста аминогрупп и карбоксильных групп оценивают методом формольного титрования, связывая формальдегидом аминогруппы аминокислот, освобождающихся при гидролизе белка. Образовавшиеся при гидролизе аминокислоты идентифицируют хроматографическими методами, основанными на различных физико-химических свойствах аминокислот.
2. Исследование последовательности аминокислот в составе белка, в свою очередь, проводится различными методами. Белки с высокой молекулярной массой предварительно подвергаются частичному ферментативному гидролизу до коротких пептидов. Затем в полученных коротких пептидах определяются последовательно более доступные для исследования концевые аминокислоты, находящиеся или на N-конце, или на С-конце пептида.
С целью распознавания С - и N -концевых аминокислот применяются ферментативныеметоды. Ферменты аминопептидазы отщепляют от пептида N - концевую аминокислоту, которая определяется хроматографически. Ферменты карбоксипептидазы, отщепляют от белка С - концевую аминокислоту.
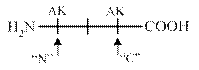
Аминопептидазы Карбоксипепетидазы
Наряду с ферментативными используются химические методы распознавания концевых аминокислот:
А) методы исследования N- концевых аминокислот заключаются в присоединении к N -концевой аминокислоте какой - то «химической метки» при помощи связи, более прочной, чем пептидная связь. При последующем  гидролизе N- концевая аминокислота оказывается связанной с каким-либо химическим веществом. - меткой. С этой целью используют реактив Сенджера - динитрофторбензол С6Н5(NO2)2F. Этот метод неудобен, тем, что он предполагает одноразовое исследование. В связи с этим чаще используют реактив Эдмана - фенилизотиоцианатнат С6Н5-N(S)=C. Одновременно с присоединением фенилизотиоцианата к N –концевой аминокислоте происходит образование циклического продукта и ослабление связи N-концевой аминокислоты с полипептидной цепью. С помощью последующего мягкого гидролиза осуществляется отщепление меченой N-концевой аминокислоты с сохранением остальной части белковой молекулы. Вторая аминокислота с N-конца в результате становится концевой и распознается повторным применением реактива (смотри схему).
гидролизе N- концевая аминокислота оказывается связанной с каким-либо химическим веществом. - меткой. С этой целью используют реактив Сенджера - динитрофторбензол С6Н5(NO2)2F. Этот метод неудобен, тем, что он предполагает одноразовое исследование. В связи с этим чаще используют реактив Эдмана - фенилизотиоцианатнат С6Н5-N(S)=C. Одновременно с присоединением фенилизотиоцианата к N –концевой аминокислоте происходит образование циклического продукта и ослабление связи N-концевой аминокислоты с полипептидной цепью. С помощью последующего мягкого гидролиза осуществляется отщепление меченой N-концевой аминокислоты с сохранением остальной части белковой молекулы. Вторая аминокислота с N-конца в результате становится концевой и распознается повторным применением реактива (смотри схему).
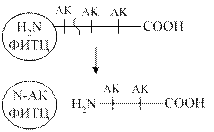
Б) Методы распознавания С - концевой аминокислоты.
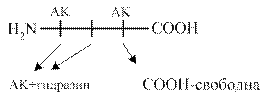
Метод Акобори заключается в использовании фенилгидразина. Фенилгидразин разрывает пептидные связи в белке и присоединяется ко всем аминокислотам, кроме C-концевой. Последующий хроматографический анализ позволяет распознать С - концевую аминокислоту в составе белка (смотри схему).
Исследование первичной структуры имеет важное общебиологическое и медицинское значение:
- Первичная структура является определяющей для последующих структур белка.
- Знание первичной структуры белка необходимо для искусственного синтеза белков с заданными биологическими свойствами
- Первичная структура определяет видовую специфичность белков, например, в белке инсулине, обычно в середине молекулы у различных видов животных и человека происходит замена, как правило, 3-х равноценных по свойствам радикалов аминокислот.
- Изменения в первичной структуре могут причиной молекулярных патологий. Например, при серповидноклеточной анемии в гемоглобине в β - цепи в 6 положении глютаминовая кислота заменяется на валин. Эта замена на неравноценную по свойствам радикала аминокислоту приводит к нарушению функции гемоглобина и появлению серповидной формы эритроцитов.
В белковой молекуле при чередовании жестких (пептидная связь) и гибких (α -углеродный атом) участков формируется компактная укладка цепи в пространстве.
Дата добавления: 2016-09-26; просмотров: 2910;











