Строение аминокислот и их свойства
Сложные белки
К сложным белкам относятся фосфопротеиды, гликопротеиды, липопротеиды, хромопротеиды и нуклеопротеиды.
Фосфопротеидысодержат остаток фосфорной кислоты, в воде нерастворимы. Фосфопротеидами являются казеиноген молока, вителин яиц, казеин творога, ихтулин икры рыб. С биологической точки зрения фосфопротеиды являются важным питательным веществом для растущих организмов. Казеиноген в воде почти не растворим; в молоке он находится в виде кальциевой соли, которая под действием кислоты расщепляется, образуя гель свободного казеиногена, в результате чего происходит свертывание молока.
Гликопротеиды – сложные белки, простетическими группами которых являются углеводы (глюкоза). При гидролизе гликопротеидов, кроме аминокислот и углеводов, нередко выделяются серная и уксусная кислоты. Основными представителями гликопротеидов являются муцины и мукоиды, которые входят в состав хрящей, костной ткани, роговицы глаз, а также встречаются в пищеварительных соках. Муцины обуславливают высокую вязкость слюны и тем самым способствуют легкому прохождению пищи через пищевод в желудок. Муцины обволакивают слизистую оболочку желудка и кишечника и предохраняют ее от воздействия протеолитических ферментов, находящихся в желудочном и кишечном соках.
Липопротеидыв качестве простетической группы содержат жиры и различные липоиды – фосфоглицериды, холестерин и др. В отличие от липидов липопротеиды растворимы в воде и нерастворимы в органических растворителях – эфире, бензоле, хлороформе. Липопротеиды широко распространены в природе, они входят в состав пластид растительной клетки, плазмы крови и протоплазмы клеток, играют большую роль в образовании мембран растений и животных, регулирующих проникновение веществ из клетки в клетку.
Прочность связи белков с жирами и липоидами у различных липопротеидов неодинакова. Иногда эта связь бывает настолько прочной, что ее можно разрушить только при длительном гидролизе, но бывает и настолько слабой, что напоминает адсорбционную связь.
Хромопротеиды состоят из простого белка и небелкового окрашенного соединения. Они весьма распространены в животных и растительных организмах. Примерами хромопротеидов могут служить соединения хлорофилла с белком, играющие важную роль в усвоении углекислоты воздуха растениями, гемоглобин крови, состоящий из белка и гема, с помощью которого осуществляется перенос кислорода и отчасти углекислоты кровью, а также гемоглобин – дыхательный пигмент мышечных клеток позвоночных и беспозвоночных животных. В состав гема входит атом двухвалентного железа, а в молекуле гемоглобина содержится четыре атома железа. Из этого следует, что в молекулу гемоглобина входят четыре гема. Очень близким к гему является зеленый пигмент хлорофилл, содержащийся в хлоропластах растений и придающий им зеленый цвет. Но в молекуле гема содержится железо, а в молекуле хлорофилла магний.
Нуклеопротеиды представляют собой белки, связанные с нуклеиновыми кислотами. Эти белки входят в состав любой клетки, являются компонентами ядра клетки и цитоплазмы, играют большую биологическую роль не только потому, что участвуют в образовании структурных элементов клеток, но и потому, что выполняют такие важные функции в организме, как передача наследственных свойств.
К группе нуклеопротеидов относятся и белки вирусов. Много нуклеопротеидов находится в зародыше злаковых растений – пшеницы, ржи и др.
Главным компонентом этих белков являются нуклеиновые кислоты. Они представляют собой полимеры, состоящие из мононуклеотидов. В состав мононуклеотидов входят пуриновые и пиримидоновые основания, пентоза и остаток фосфорной кислоты:
Основание – сахар – фосфорная кислота < Основание – сахар – фосфорная кислота < Основание – сахар – фосфорная кислота <
В некоторых нуклеиновых кислотах в небольших количествах вместо пентозы находится глюкоза.
Состав нуклеотидов и последовательность их расположения характеризуют особенности отдельных нуклеиновых кислот. Нуклеиновые кислоты обладают огромным молекулярным весом, превышающим иногда 10 000 000. Длина нуклеотидных цепочек в отдельных случаях достигает 0,5 см. Нуклеиновые кислоты находятся в клетках живых организмов вместе с белками, соединяются с ними, образуя нуклеопротеиды.
По структуре и функциям различают два типа нуклеиновых кислот – РНК (рибонуклеиновые) и ДНК (дезоксирибонуклеиновые). В молекуле РНК находится рибоза, в молекуле ДНК – дезоксирибоза. Кроме того, РНК и ДНК различаются составом азотистых оснований, входящих в их молекулу (табл. 26). ДНК сосредоточена главным образом в ядрах клеток, а РНК – только в протоплазме.
| Химическое соединение в составе нуклеиновых кислот | Тип нуклеиновых кислот | |
| ДНК | РНК | |
| Пуриновые основания | Аденин Гуанин | Аденин Гуанин |
| Пиримидиновые основания | Цитозин Тимин | Цитозин Урацил |
| Углеводы | D-дезоксирибоза | D-рибоза |
| Неорганическое соединение | Фосфорная кислота | Фосфорная кислота |
Нуклеиновым кислотам принадлежит важнейшая роль в биосинтезе макромолекул, в том числе белковых. Генетическую информацию переносит только ДНК.
Различное сочетание в цепочке нуклеиновых кислот отдельных компонентов обусловливает огромное разнообразии нуклеиновых кислот и выполняемых ими функций в живом организме.
Различают три типа РНК – информационную (и-РНК), транспортную (т-РНК) и рибосомальную (р-РНК). Информационная РНК снимает с ДНК ядра информацию и переносит ее к месту синтеза белка; является связующим звеном между ДНК и другими клеточными элементами, и в первую очередь с белками. Транспортная РНК выполняет функцию переносчика активированных аминокислот к месту синтеза белка; так как аминокислот не менее 20, то должно быть не менее 20 разновидностей т-РНК; молекулярный вес т-РНК составляет 25 000 –35 000. Рибосомальная РНК находится в рибосомах клетки, в которых происходит синтез белка; р-РНК обладает большим молекулярным весом (от 1 500 000 до 2 000 000), в состав ее молекулы входят до 4000 –6000 нуклеотидов.
Белки муки, крупы, хлеба, картофеля, большинство белков мяса, рыбы, яиц – протеины; протеиды находятся в цитоплазме и ядрах клеток, в зародышах хлебных злаков, в гречневой крупе, частично в белках мяса, рыбы, молока и др. продуктов.
Под действием ферментов, кислот и щелочей белки гидролизуются до аминокислот. В пищевых продуктах гидролиз белков может играть положительную (в сочетании с другими процессами благотворно влияет на качество сыра при его созревании) или отрицательную (глубокий гидролиз белков с дальнейшим расщеплением аминокислот при порче мяса, рыбы) роль.
Строение аминокислот и их свойства
При гидролизе под действием крепких кислот или щелочей, а также под влиянием протеолитических ферментов белки распадаются на более простые соединения, образуя смесь α-аминокислот. В качестве промежуточных продуктов гидролиза белка последовательно в небольших количествах появляются полипептиды.
В состав белков входит около 20 аминокислот и иногда еще два амида – аспарагин (амид аспарагиновой кислоты) и глутамин (амид глутаминовой кислоты). Однако известно мало белков, которые содержали бы все аминокислоты.
Помимо аминокислот, которые образуют белки, в природе известно еще 150 других аминокислот, но они не входят в состав ни одного из известных белков.
Аминокислоты, которые содержат одну амино- и одну карбоновую группу, называют моноаминокарбоновыми. Если аминокислоты содержат две амино- и одну карбоновую группу, то их называют диаминомонокарбоновыми. Если в аминокислоту входят одна амино- и две карбоновые группы, то их называют моноамидодикарбоновыми. Наконец, при наличии в аминокислоте двух амино- двух карбоновых групп их называют диаминодикарбоновыми.
Все аминокислоты, входящие в состав белков, делят на две группы – ациклические (жирного ряда) и циклические (ароматического ряда). Большинство аминокислот относятся к группе ациклических, молекулы которых не имеют кольцевых структур.
Классификацию аминокислот можно представить в следующем виде:
Ациклическиеаминокислоты, которые делят на:
моноаминокарбоновые (1 NH2, 1 COOH) – гликокол (глицин), аланин, серин, цистеин, метионин, треонин, валин, лейцин, изолейцин;
диаминомонокарбоновые (2 NH2, 1 COOH) – лизин, аргинин;
моноаминодикарбоновые (1 NH2, 2 COOH) – аспарагиновая, глутаминовая кислоты;
диаминодикарбоновые (2 NH2, 2 COOH) – цистин.
Циклические аминокислоты, которые делят на:
гомоциклические – фенилаланин, тирозин;
гетероциклические – триптофан, гистидин, пролин, оксипролин.
Большая часть аминокислот представляет собой производные жирных кислот, у которых у α-углеродного атома один атом водорода замещен на аминную группу:
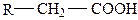
| 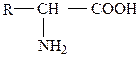
|
| жирная кислота | аминокислота |
Построенные подобным образом аминокислоты принадлежат к моноаминомонокарбоновым. Они содержат как кислотную группу – карбоксильную, так и щелочную – аминную. Поэтому в водных растворах они обладают нейтральной реакцией, так как в каждой молекуле аминокислоты на одну кислотную группу приходится одна основная.
Аминокислоты относятся к амфотерным электролитам, они обладают свойствами кислот и оснований.
В водном растворе карбоксильная группа отщепляет ионы водорода, и аминокислота начинает функционировать как кислота. В тоже время основные группы аминокислот в растворе являются источником гидроксильных ионов, что определяет основные свойства аминокислоты
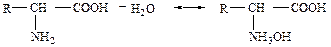 .
.
Следовательно, аминокислоты являются одновременно и кислотами, и основаниями. Поэтому в зависимости от состава раствора аминокислоты способны образовывать различные соли, реагируя как с кислотами, так и с основаниями:
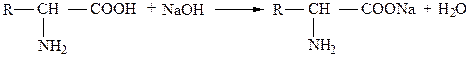
натриевая соль аминокислоты
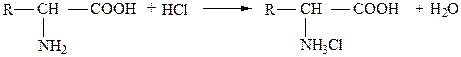
солянокислая соль аминокислоты.
Водные растворы моноаминодикарбоновых кислот обладают кислой реакцией, так как у них на одну основную группу приходится две кислотные. Диаминокарбоновые аминокислоты в водных растворах обладают щелочной реакцией.
Все аминокислоты в водных растворах диссоциируют на ионы:
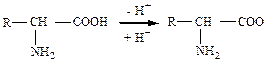 .
.
Существуют реакции, которые характерны для всех аминокислот и часто используются как для качественного, так и количественного их определения.
Карбоксильная группа аминокислот может реагировать со спиртами, образуя при этом сложные эфиры:
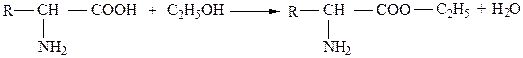 .
.
Разные аминокислоты со спиртами образуют эфиры, различающиеся физико-химическими свойствами. Реакция этерификации применяется для разделения и определения аминокислот путем фракционной перегонки.
Почти все аминокислоты реагируют с нингидрином (дикетогидриндегидра-том), причем характер образующихся продуктов зависит от рН среды. Реакция с нингидрином широко применяется для идентификации и количественного определения свободных аминокислот по выделившемуся углекислому газу или по интенсивности образующейся сине-фиолетовой окраски. Реакция с нингидрином широко применяется в лабораторной практике при хроматографическом определении аминокислот на бумаге.
Аминокислоты могут вступать в реакцию с соединениями, содержащими карбонильную группу С=О, например с различными альдегидами и редуцирующими сахарами. При этой реакции происходит расщепление как исходной аминокислоты, так и реагирующего с ней редуцирующего сахара. При этом из аминокислоты образуется соответствующий альдегид, аммиак и углекислота, а из сахара – фурфурол или метилфурфурол. Так, при реакции аминокислоты с ксилозой образуется изовалериановый альдегид, аммиак, углекислота и фурфурол:
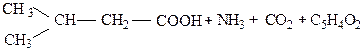
изовалериановый альдегид фурфурол.
Альдегиды, образующиеся в результате взаимодействия аминокислот с редуцирующими сахарами, обладают определенным запахом, от которого в значительной степени зависит аромат многих пищевых продуктов – печеного хлеба, стерилизованного молока, чая, кофе и др.
Фурфурол и оксиметилфурфрол, получающиеся в результате расщепления сахара, легко вступают в соединение с аминокислотами и белками, образуя при этом темно-окрашенные продукты, называемые меланоидинами. Образование меланоидинов является причиной потемнения многих пищевых продуктов при их изготовлении, сушке и хранении, например сушеного картофеля и капусты – при хранении, а солода, молока, фруктов и других продуктов – при сушке. Реакция образования меланоидинов происходит интенсивнее при повышенной температуре.
С азотистой кислотой реагируют аминогруппы аминокислот, при этом выделяется азот:
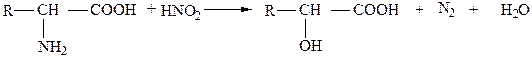 .
.
По количеству выделившегося азота судят о количестве аминогрупп. Эта реакция служит также для количественного определения аминокислот по Ван-Сляйку.
Все аминокислоты, за исключением гликола, являются оптически активными, т.е. способны в жидком и газообразном состоянии и в растворах вращать плоскость поляризации света. Все правовращающие аминокислоты обозначаются знаком «+», а левовращающие – знаком «-».
| <== предыдущая лекция | | | следующая лекция ==> |
| Классификация белков | | | ОПРЕДЕЛЕНИЕ ТВЕРДОСТИ МАТЕРИАЛОВ |
Дата добавления: 2016-09-26; просмотров: 2895;











