Классификация белков
Свойства белков
Молекулы белков построены из остатков сотен и тысяч аминокислот, соединенных пептидной связью:
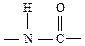
Такая связь образуется после выделения молекулы воды за счет аминогруппы одной аминокислоты и карбоксильной группы другой аминокислоты. Продукт соединения аминокислот называют пептидом. В зависимости от количества остатков аминокислот, образующих пептиды, различают дипептиды, трипептиды и т.д. Продукты соединения многих аминокислот называют полипептидами. Белок можно рассматривать как высокомолекулярный полипептид.
Многие полипептиды встречаются в свободном виде в тканях животных и растений. Так, простой полипептид глютатион является сильным восстановителем и легко подвергается окислению. Глютатион оказывает также большое влияние на активность многих ферментов, особенно тех, действие которых связано с превращением белков. Некоторые антибиотики, образующиеся микроорганизмами, например, грамицидин, являются полипептидами. Они применяются в медицине для борьбы с патогенными микроорганизмами.
Отдельные белки различаются по аминокислотному составу, т.е. по количеству образующихся из них при гидролизе аминокислот. Аминокислотная последовательность является специфичной для определенного белка. В настоящее время известен аминокислотный состав многих белков, однако последовательность расположения аминокислот установлена только для небольшого количества белков.
Все белки по форме молекул делят на две основные группы: фибриллярные и глобулярные. Молекулы фибриллярных белков (таких как миозин, коллаген, кератин) представляют собой нитевидно вытянутые полипептидные цепи; эти белки принимают участие в построении опорных тканей, особенно важно их участие в построении мышечной ткани (лат. фибрилла – волокно). Молекулы глобулярных (лат. глобулюс – шар) белков могут иметь форму от шаровидной (сильно скрученная спираль) до веретенообразновытянутой и даже палочковидной. К глобулярным принадлежит преобладающее количество белков животных, растений и микроорганизмов (таких как альбумины, глобулины, миоген). Глобулярные белки имеют наиболее высокую молекулярную массу, и чтобы уложиться в ограниченное, занимаемое молекулой пространство, полипептидная цепь сворачивается в разнообразные по форме белковые клубки, структура которых поддерживается водородными, дисульфидными, амидными и сложноэфирными связями. При нагревании белковых растворов или под действием спирта, кислот, щелочей и некоторых реагентов глобулярные белки могут превращаться в фибриллярные, теряя при этом свои нативные свойства. Определенная прочность структуры обеспечивается тем, что связей в белковой молекуле так же много, как и аминокислотных остатков. Большой размер, сложность строения молекул белка обусловливают малую устойчивость ее, при расщеплении получаются полипептиды и аминокислоты (все продукты расщепления белков растворяются в воде).
Для каждого белка характерна структура, в которой он стабилен и проявляет свойственную ему биологическую активность. Различают первичную, вторичную, третичную и четвертичную структуру белков. Составом и последовательностью аминокислот в молекуле обусловлена первичная структура белка. Элементы первичной структуры белковой молекулы обычно имеют не линейную цепочку, а форму изогнутой спирали, так называемой α-спирали. В конфигурации α-спирали находится более половины аминокислот природных нативных белков. Зная первичную структуру белка, можно написать полную его формулу.
Скрученность полипептидной цепочки в молекуле белка определяет его вторичную структуру. Длинные цепи белков изогнуты в виде спирали или образуют складки. Чаще всего распространена α-спираль, в которой пептидная цепь закручена по часовой стрелке. Такой способ свертывания полипептидной цепи характеризует вторичную структуру белка.
Если белковые молекулы изгибаются наподобие жгута и укладываются в клубок, образуя глобулу, то такую структуру белка называют третичной (конформация). При изменении конформации изменяются и свойства белка.
Многие белки образуют комплексы из нескольких молекул, функционирующие как единое целое. Такие комплексы называют четвертичной структурой белка (миоглобин).
Белки многих пищевых продуктов (мяса, молока, плодов, овощей, зерна, яиц и др.) чрезвычайно сложны по строению, и воздействие на эти продукты высокой температуры, спирта, некоторых солей может приводить к нарушению конфигурации белков, а, следовательно, к изменению их структуры и свойств.
Белки, состоящие из остатков α-аминокислот, содержат определенное количество аминных и карбоксильных групп, поэтому подобно аминокислотам также являются амфотерными электролитами. Они могут диссоциировать и как кислоты, и как основания. В щелочной среде белок будет диссоциировать как кислота, а в кислой как щелочь, поэтому в щелочном растворе молекулы белка будут заряжены отрицательно, а в кислом – положительно. Если через щелочной раствор белка пропускать электрический ток, то молекулы белка будут двигаться к аноду, а в кислом растворе – к катоду. В изоэлектрической точке, т.е. в той среде, в которой будет равенство положительных и отрицательных зарядов, и когда электрический заряд равен нулю, белковые молекулы остаются неподвижными и не передвигаются ни к аноду, ни к катоду. Изоэлектрическая точка разная для различных белков. Так, изоэлектрическая точка белка пшеничного зерна глиадина равна рН 7,1, белка кукурузного зерна зеина – рН 6,2, белка семян конопли эдестина – рН 5,5, яичного альбумина – рН 4,8. В изоэлектрической точке растворы белка наименее устойчивы и легко осаждаются.
Очень важным свойством белков является их растворимость. Многие белки растворяются в воде, другие – только в солевых растворах или в спирте определенной концентрации, а некоторые не растворяются вовсе. Степень растворимости белков в воде определяется видом и числом аминокислот, их расположением, величиной рН и концентрацией солей растворов. При равном количестве положительных (NН) и отрицательных (СООН) групп растворимость белка наименьшая, и он легко выпадает из раствора в осадок. Большинство белков имеет кислую реакцию, что способствует при физиологических условиях связыванию значительного количества воды. Связывание белком воды осуществляется также его пептидными связями. Растворимость белков зависит от температуры: одни белки лучше растворяются при высокой, другие – при пониженной температуре.
С растворимостью белков в известной степени связана их усвояемость организмом человека. Легче всего усваиваются растворимые белки и почти не усваиваются белки нерастворимые. Растворимые белки при нагревании до +70….+80 0с свертываются (денатурируют).
При удалении воды из белков их структура обычно нарушается, однако сублимационная сушка, когда вода вымораживается при низких температурах под глубоким вакуумом, способствует сохранению нативной (первоначальной) структуры белков.
Белковые частицы нерастворимых белков мяса, рыбы, сыра и других продуктов находятся в набухшем состоянии. Эти белковые частицы способны при определенных условиях соединяться в крупные желеобразные белковые образования (студень, простокваша, творог), массовая доля воды в которых зависит от температуры, кислотности и других факторов.
Белки оптически деятельны, так как они состоят из молекул аминокислот, которые являются оптически активными. Белки в растворах вращают плоскость поляризации влево, и только белок гемоглобин вращает плоскость поляризации вправо.
Классификация белков
В основу классификации белков положены их физико-химические и химические особенности. Белки делят на простые (протеины) и сложные (протеиды). К простым относят белки, которые при гидролизе дают только аминокислоты и аммиак, к сложным – белки, состоящие из простых белков и соединений небелковой группы, называемой простетической. (табл. 25)
Простые белки
К простым белкам относят протамины, гистоны, альбумины, глобулины, проламины, глютелины, протеиноиды.
Протаминыотличаются небольшим молекулярным весом, не превышающим 10000. Растворимы в воде, обладают щелочной реакцией, так как в молекуле этих белков содержится до 80 % остатков диаминомонокарбоновых кислот. Протамины находятся преимущественно в икре и молоках некоторых пород рыб.
Гистоны по свойствам близки к протаминам, растворимы в воде, а их растворы обладают щелочной реакцией. При нагревании денатурируются. Встречаются они в животных продуктах, некоторые из гистонов входят в состав гемоглобина крови.
Альбумины растворимы в воде. При кипячении свертываются (миоальбумин при 45 0С, миоген при 60 0С) и выпадают в осадок в виде густых хлопьев денатурированного белка, некоторые из них получены в кристаллическом виде. При действии на их водные растворы сернокислого аммония высаливаются. Содержат много серы – до 2,25%. Это хорошие белки для питания (особенно молодых организмов) благодаря входящей в их состав серосодержащей аминокислоте – цистину. Важнейшим представителями этих белков являются альбумин яичного белка (овальбумин), лактоальбумин (белок молока), сывороточный альбумин крови, лейкозин пшеницы, легумелин гороха. Пена, образующаяся при варке плодов и овощей, частично состоит из свернувшихся растительных альбуминов. Образование пенки на молоке, загустение содержимого яиц при варке объясняется денатурацией альбуминов. Чтобы предупредить переход альбуминов в холодную воду, продукты, содержащие их, при варке кладут в горячую воду.
Глобулины нерастворимы в чистой воде, но в 5 – 15%-ных растворах нейтральных солей растворяются, хорошо высаливаются, при нагревании свертываются. Растительные глобулины содержат больше азота, труднее высаливаются и свертываются, чем животные. Потери белковых веществ мяса, посоленного до варки, за счет растворения глобулинов значительно больше, чем сваренного без соли.
Глобулины широко распространены в пищевых продуктах. В горохе содержится белок легумин, в сое – глиципин, в семенах фасоли – фазеолин, в картофеле – туберин, в крови – фибриноген, в молоке – лактоглобулин, в яйцах – яичный глобулин; важнейший белок мышц – миозиноген.
Проламины незначительно растворяются в воде, но хорошо растворяются в 60 – 80 %-ном этиловом спирте, тогда как другие белки в спиртовых растворах указанной концентрации денатурируют и выпадают в осадок. Проламины встречаются только в семенах растений. К ним относятся глиадин семян пшеницы и ржи, гордеин семян ячменя, зеин семян кукурузы, авенин семян овса.
Глютелины встречаются исключительно в семенах злаковых и зеленых частях растений. Эти белки нерастворимы в воде, нейтральных солях и спирте, но растворимы только в слабых растворах щелочей. Типичным представителями таких белков являются глютелин пшеницы и ржи, оризенин риса, глютелины кукурузы, ячменя, овса.
Проламины и глютелины при замешивании муки с водой образуют клейковину теста, благодаря которой оно приобретает эластичность.
Протеиноиды нерастворимы в воде, слабых кислотах и щелочах. Встречаются они только в тканях животных. К протеиноидам относятся коллаген – основной белок кожи, костей и хрящей, эластин – белок сухожилий и соединительной ткани, кератин – белок волос, шерсти, копыт и рогов. Все протеиноиды растворяются только при энергичной обработке кислотами и щелочами. Коллаген, долго нагреваемый в воде при 56 – 100 оС, переходит в растворимый клей, или глютин (желатин), который охлаждаясь, застывает и образует студень. На этом свойстве желатина основано приготовление заливных блюд. Полагают, что образование глютина является результатом распада сложных мицелл коллагена на более простые.
Таблица 25
| Группа белка | Представители группы белка | |
| Простые белки | ||
| Протамины | Клупеин молок сельдей, сальмин молок лососей, стурин молок осетра, скумбрин молок скумбрии | |
| Гистоны | Глобин, входящий в состав гемоглобина крови и миоглобина мяса, обуславливающий окраску крови и мяса | |
| Альбумины | альбумин яичного белка (овальбумин); лактоальбумин (белок молока); сывороточный альбумин крови; миоген и миоальбумин мышечной ткани мяса; лейкозин пшеницы, ячменя, ржи; легумелин гороха, сои, бобовых | |
| Глобулины | В горохе содержится белок легумин, в сое – глиципин, в семенах фасоли – фазеолин, в картофеле – туберин, в крови – фибриноген, в молоке – лактоглобулин, в яйцах – яичный глобулин, важнейший белок мышц – миозиноген, орхин арахиса | |
| Проламины | глиадин семян пшеницы и ржи, гордеин семян ячменя, зеин семян кукурузы, авенин семян овса | |
| Глютелины | глютелин пшеницы и ржи, оризенин риса, глютелины кукурузы, ячменя, овса | |
| Протеноиды | коллаген – основной белок кожи, костей и хрящей, эластин – белок сухожилий и соединительной ткани, кератин – белок волос, шерсти, копыт и рогов, хитин панциря насекомых и ракообразных | |
| Сложные белки | ||
| Фосфопротеиды | казеиноген молока, вителин яиц, казеин творога, ихтулин икры рыб | |
| Гликопротеиды | муцины и мукоиды, белки хрящей, костной ткани, роговицы глаз, слизистых оболочек, а также встречаются в пищеварительных соках | |
| Липопротеиды | входят в состав пластид растительной клетки, находятся в яичном желтке, плазме крови и протоплазмы клеток, нервной ткани | |
| Хромопротеиды | гемоглобин крови, миоглобин мышечной ткани, соединение хлорофилла с белком | |
| Нуклеопротеиды | соединения протаминов и гистонов с нуклеиновыми кислотами, входят в состав любой клетки, являются компонентами ядра клетки и цитоплазмы | |
| <== предыдущая лекция | | | следующая лекция ==> |
| Общая характеристика белков | | | Строение аминокислот и их свойства |
Дата добавления: 2016-09-26; просмотров: 4130;











